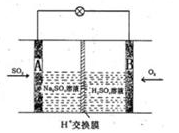
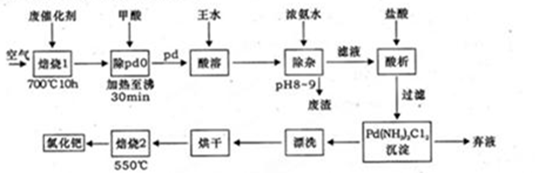
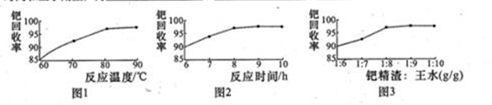
-
化学与环境保护、工业生产、生活等密切相关。下列说法不正确的是
A.PM2.5J是指大气中直径小于或等于2.5微米的颗粒物。PM2.5比胶体粒子小,因其比表面积大,故可吸附含有铅、镉、铬、钒、砷等对人体有害的重金属离子,入肺后对人体产生很大的危害
B.富含氮、磷的生活污水不能排放到河中,也不能直接用于农田的灌溉
C.大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染
D.14C可用于文物的年代鉴定,14C和12C互为同位素
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A.标准状况下,44.8L NO与22.4L O2混合气体中分子总数等于3NA
B.Al2(SO4)3溶液中还可以大量存在Na+、K+、CO2—3、NO—3
C.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO—+SO2+H2O=CaSO3+2HClO
D.2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA
难度: 中等查看答案及解析
-
下列与有机物的结构、性质有关的叙述正确的是
A.聚氯乙烯、油脂均能使酸性KMnO4溶液褪色
B.石油的主要成分是烃,煤经过分馏可制得焦炭、煤焦油等产品
C.淀粉、纤维素的组成都可以用(C6H10O5)n表示,二者互为同分异构体
D.乙酸和乙醇可以生酯化反应,又都可以与钠发生置换反应
难度: 中等查看答案及解析
-
常温下,0.1mol/L氨水溶液中
=1×10-8,下列叙述不正确的是
A.该溶液中氢离子的浓度:c(H+)=1×10-11mol/L
B.0.1mol/L氨水溶液与0.1mol/L HCl溶液等体积混合后所得溶液中:c(NH+4)+c(H+)=c(Cl—)+c(OH+)
C.0.1mol/L的氨水溶液与0.05mol/L H2SO4溶液等体积混合后所得溶液中:c(NH+4)+c(NH3)+c(NH3·H2O)=2c(SO2—4)
D.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)
难度: 极难查看答案及解析
-
有机物A和B,只由C、H、O两种或三种元素组成,相同物质的量的A和B完全燃烧时,消耗氧气的物质的量相等,下列对A、B的判断肯定错误的是(n是不为零的正整数)
A.A与B互为同分异构体
B.A与B的分子组成相差n个“CO2”
C.A与B的分子组成相差n个“CH2”
D.A与B的分子组成相差n个“H2O”
难度: 中等查看答案及解析
-
实验是化学研究的基础。下列关于各实验装置的叙述不正确的是

A.装置①可用于乙醇与水的分离
B.装置②所示实验可比较硫、碳、硅三种元素的非金属性强弱
C.装置③,关闭弹簧夹,向长颈漏斗中注水后,长颈漏斗内水面高度保持不变能说明装置不漏气
D.图④装置可用来称量一定质量的NaOH固体
难度: 中等查看答案及解析
-
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是

A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
难度: 困难查看答案及解析