-
下列说法不正确的是( )
A.多孔碳可用作氢氧燃料电池的电极材料
B.pH计不能用于酸碱中和滴定终点的判断
C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素
D.和CO2反应生成可降解聚合物,反应符合绿色化学的原则难度: 中等查看答案及解析
-
下列说法正确的是( )
A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B.用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度
C.Cl-存在时,铝表面的氧化膜易被破坏,因此含盐腌制食品不宜直接存放在铝制容器中
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
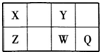
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体难度: 中等查看答案及解析
-
下列说法正确的是( )
A.按系统命名法,化合物的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段的高聚物,其单体是苯酚和甲醛难度: 中等查看答案及解析
-
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法不正确的是( )
A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH-
B.电解结束后,右侧溶液中含有IO3-
C.电解槽内发生反应的总化学方程式:KI+3H2OKIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内总反应不变难度: 中等查看答案及解析
-
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
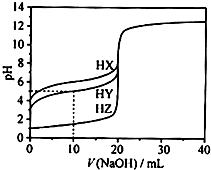
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)=+c(Z-)+c(OH-)
难度: 中等查看答案及解析
-
现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀.该同学得出的结论正确的是( )
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+难度: 中等查看答案及解析