-
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3•H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A. 未加盐酸时:c(OH-)>c(Na+)= c(NH3•H2O)
B. 加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-)
C. 加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D. 加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
难度: 中等查看答案及解析
-
下列物质中,属于强电解质的是
A.
B.
溶液 C.
D.
难度: 简单查看答案及解析
-
下列电离方程式书写正确的是
A. CH3COOH
H++CH3COO-
B. NaHSO4
Na++H++SO42-
C. H2CO3
2H++CO32-
D. NaHCO3
Na++HCO3-
难度: 简单查看答案及解析
-
常温下,下列离子能使纯水中的H+离子数目增加的是
A. S2- B. CO32- C. NH4+ D. Br-
难度: 中等查看答案及解析
-
下列水解化学方程式或水解离子方程式正确的是: ( )
A. CH3COO— + H2O
CH3COOH + OH— B. NH4+ + H2O=NH4OH + H+
C. CH3COOH + NaOH
CH3COONa + H2O D. NaCl + H2O
NaOH + HCl
难度: 简单查看答案及解析
-
用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是 ( )
A. 稀HCl溶液 B. 稀Na2SO4溶液 C. CuCl2溶液 D. AgNO3溶液
难度: 中等查看答案及解析
-
将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c(NH4+)=c(Cl-) ⑤c(NH4+)<c(Cl-)正确的是( )
A. ①⑤ B. ③④ C. ②⑤ D. ②④
难度: 中等查看答案及解析
-
相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
使10 mL浓度为1 mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的量的是
A. KNO3 B. CH3COONa C. CuSO4 D. Na2CO3
难度: 中等查看答案及解析
-
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是
A. 充电时作阳极,放电时作正极
B. 充电时作阳极,放电时作负极
C. 充电时作阴极,放电时作负极
D. 充电时作阴极,放电时作正极
难度: 中等查看答案及解析
-
下列各个装置中能组成原电池的是( )
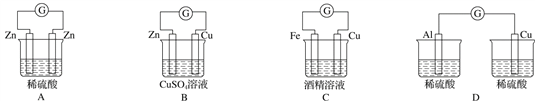
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某原电池总反应的离子方程式为:2Fe3++Fe=3 Fe2+,能实现该反应的原电池是
A. 正极为铜,负极为铁,电解质溶液为FeCl2溶液
B. 正极为C,负极为铁,电解质溶液为Fe(NO3)3溶液
C. 正极为铁,负极为锌,电解质溶液为Fe2(SO4)3
D. 正极为银,负极为铁,电解质溶液为CuSO4溶液
难度: 中等查看答案及解析
-
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池 如图所示。下列说法正确的是

A. 银电极为负极 B. X电极是锌电极
C. 去掉盐桥电流计指针仍偏转 D. Y溶液为AgNO3溶液
难度: 简单查看答案及解析
-
右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑。下列说法错误的是
A. a、b不可能是同种材料的电极
B. X为电流计,c为稀盐酸,该装置为原电池
C. X为直流电源,c为稀硫酸,该装置为电解池
D. X为电流计,c为稀硫酸,a可能为铜电极,b可能为锌电极
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O⇌H++OH—;△H>0,下列叙述正确的是
A. 将纯水加热到95℃,KW变大,PH不变,水仍呈中性
B. 向纯水中加入稀氨水,平衡逆向移动,c(OH—)降低
C. 向纯水中加入少量固体硫酸氢钠,c(H+)增 大,KW不变,影响水的电离平衡
D. 向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变
难度: 简单查看答案及解析
-
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
A. 溶液中Ca2+数目增多 B. 溶液中c(Ca2+)增大
C. 溶液pH值不变 D. 溶液pH值增大
难度: 简单查看答案及解析
-
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42﹣)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 中等查看答案及解析
-
在25℃时,用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L,随着溶液的稀释,下列各项中始终保持增大的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入

A. 0.1 mol CuO B. 0.05 mol Cu2(OH)2CO3
C. 0.1 mol Cu(OH)2 D. 0.1 mol CuCO3
难度: 困难查看答案及解析
-
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式:2AgCl+ Mg = Mg2++ 2Ag+2Cl-。有关该电池的说法正确的是( )
A. Mg为电池的正极 B. 负极反应为AgCl+e-=Ag+Cl-
C. 不能被KCl溶液激活 D. 可用于海上应急照明供电
难度: 中等查看答案及解析
-
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
难度: 中等查看答案及解析


