-
在d轨道中电子排布成
,而不排布成
,其最直接的根据是( )
A. 能量最低原则 B. 泡利不相容原理
C. 原子轨道的形状 D. 洪特规则
难度: 简单查看答案及解析
-
下列物质中的离子键最强的是 ( )
A. KCl B. CaCl2 C. MgO D. Na2O
难度: 简单查看答案及解析
-
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于 ( )
A. 1.7 B. 2.0 C. 12.0 D. 12.4
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5 则下列有关比较中正确的是( )
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O===O:498,则反应P4(白磷)+3O2===P4O6的反应热ΔH为( )
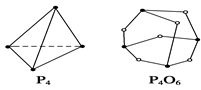
A. -1 638 kJ·mol-1 B. 1 638 kJ·mol-1 C. -126 kJ·mol-1 D. 126 kJ·mol-1
难度: 简单查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是 ( )
A. 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C. 2p轨道上只有一对成对电子的X原子与3p轨道上只有一对成对电子的Y原子
D. 最外层都只有一个电子的X、Y原子
难度: 中等查看答案及解析
-
下列各项中表述正确的是( )
A. CO2的分子模型示意图:
 B. F-的离子结构示意图:
B. F-的离子结构示意图:C. CO2的电子式:
D. N2的结构式:
:N≡N:
难度: 中等查看答案及解析
-
下列各组离子,能在指定溶液中共存的是( )
①无色溶液中:K+、Cl-、Na+、HCO3-、OH-
②使pH试纸变深蓝色的溶液中:K+、CO32-、Na+、AlO2-
③水电离的c(H+)=10-12 mol·L-1的溶液中:ClO-、HCO3-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42-
⑤使甲基橙变红的溶液中: MnO4-、NO3-、SO42-、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3-、Cl-、SO32-
A. ①③ B. ②④⑤ C. ①②⑤ D. ③⑥
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A. 用惰性电极电解熔融氯化钠: 2Cl-+2H2O= Cl2↑+H2↑+2OH-
B. 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O+H2O
C. Fe(NO3)3溶液中加入过量的HI溶液: 2Fe3++ 2I-= 2Fe 2++I2
D. NaNO2溶液中加入酸性KMnO4溶液: 2MnO4-+5NO2--+6H+=2Mn2++5NO3-+3H2O
难度: 中等查看答案及解析
-
用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A. 配制标准溶液的固体KOH中混有NaOH杂质
B. 滴定终点读数时,仰视滴定管的刻度,其他操作正确
C. 盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
难度: 中等查看答案及解析
-
有关下列两种溶液的说法中,正确的是( )
溶液①:0.2 mol·L-1CH3COONa溶液;溶液②:0.1 mol·L-1H2SO4溶液
A. 相同温度下,溶液中水的电离程度:溶液①<溶液②
B. 加水稀释溶液①,溶液中
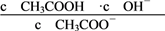 变大
变大C. 等体积混合溶液①和溶液②,所得溶液中c(CH3COO-)+2c(SO
)=c(Na+)
D. 25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(SO
)
难度: 中等查看答案及解析
-
实验室欲配制一种仅含有四种离子(不考虑水电离产生的离子)的溶液,且溶液中四种离子的浓度均相等,能达到此目的的是( )
A. Na+、Mg2+、SO42-、Cl- B. ClO-、I-、NH4+、Ba2+
C. Na+、AlO2-、K+、HCO3- D. Al3+、K+、SO42-、NO3-
难度: 中等查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是( )
实验目的
实验操作
A
NaOH固体
先在托盘上各放一张滤纸,然后在右盘上添加2 g砝码,左盘上添加NaOH固体
B
配制FeCl3溶液
将FeCl3固体溶于适量蒸馏水
C
检验溶液中是否含NH
取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各溶液中,粒子的物质的量浓度关系正确的是( )
A. 向醋酸钠溶液中加入适量醋酸得到酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 0.1 mol·L-1NH4Cl溶液:c(NH
)=c(Cl-)
C. 0.1 mol·L-1Na2CO3溶液:c(OH-)=c(H+)+c(HCO
)+2c(H2CO3)
D. 向硝酸钠溶液中滴加稀盐酸得到pH=5的溶液:c(Na+)=c(NO
)+c(Cl-)
难度: 中等查看答案及解析
-
关于下图所示的原电池,下列说法正确的是( )
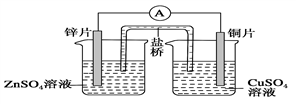
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向CuSO4溶液中迁移
C. 锌电极发生还原反应,铜电极发生氧化反应
D. 铜电极上发生的电极反应是2H++e-===H2↑
难度: 中等查看答案及解析
-
用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )
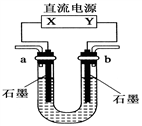
选项
电源
X极
实验前U形管中液体
通电后现象及结论
A
正极
Na2SO4溶液
U形管两端滴入酚酞试液后,a管中呈红色
B
正极
AgNO3溶液
b管中电极反应式是4OH--4e-===2H2O+O2↑
C
负极
KCl和CuCl2混合溶液
相同条件下,a、b两管中产生的气体总体积可能相等
D
负极
Fe(OH)3胶体和导电液
b管中液体颜色加深
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在100 mL H2SO4和CuSO4的混合液中,用石墨作电极电解,两极上均收集到2.24 L气体(标准状况),则原混合液中Cu2+物质的量浓度为( )
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
难度: 中等查看答案及解析