-
下列关于常见有机物的说法不正确的是( )
A.乙烯和苯都能与溴水反应
B.乙酸和油脂都能与氢氧化钠溶液反应
C.糖类和蛋白质都是人体重要的营养物质
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag
B.碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O
C.少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O难度: 中等查看答案及解析
-
下列有关物质检验的实验结论正确的是( )
选项 实 验 操 作 及 现 象 实 验 结 论 A 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中一定含有SO42- B 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 该溶液中一定含有Fe2+ C 将某气体通入品红溶液中,品红溶液褪色 该气体一定是SO2 D 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 该物质一定属于醛类
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变难度: 中等查看答案及解析
-
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两溶液中c(H+)相同
B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小难度: 中等查看答案及解析
-
材料与化学密切相关,表中对应关系错误的是( )
材料 主要化学成分 A 刚玉、金刚石 三氧化二铝 B 大理石、石灰石 碳酸钙 C 普通水泥、普通玻璃 硅酸盐 D 沙子、石英 二氧化硅
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
人类生产活动中过度排放有关物质是造成环境污染的主要原因.二氧化碳过度排放导致( )
A.全球气候异常
B.酸雨
C.光化学烟雾
D.臭氧层破坏难度: 中等查看答案及解析
-
难溶于水的金属氧化物是( )
A.SiO2
B.CO2
C.Na2O2
D.MnO2难度: 中等查看答案及解析
-
设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
A.1mol硫酸钾中阴离子所带电荷数为nA
B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有3nA个氢原子
C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为nA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nAFe3+难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁难度: 中等查看答案及解析
-
有关实验的叙述,正确的是( )
A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小难度: 中等查看答案及解析
-
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示.据图判断正确的是( )
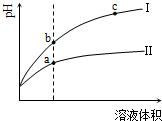
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度难度: 中等查看答案及解析
-
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y.下列说法正确的是( )
A.还原性:X的氢化物>Y的氢化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX2、M2Y都是含有极性键的极性分子
D.Z元素的最高价氧化物的水化物的化学式为HZO4难度: 中等查看答案及解析
-
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是( )
A.
B.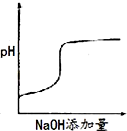
C.
D.
难度: 中等查看答案及解析
-
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
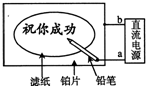
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极难度: 中等查看答案及解析