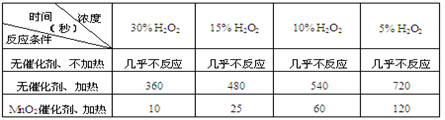
-
有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显变化;如果把Cu浸入c的盐溶液里,有c的单质析出。据此判断它们的活动性由强到弱的顺序是( )
A.d、c、a、b B.d、b、a、c C.d、a、b、c D.b、a、d、c
难度: 中等查看答案及解析
-
下列反应中,既属于氧化还原反应,又是放热热反应的是 ( )
A.铝片与稀盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.盐酸在烧碱溶液反应
难度: 中等查看答案及解析
-
X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是( )
A.化合物XZ3中各原子均满足8电子的稳定结构
B.常温下,Z单质可与Y的氢化物发生置换反应
C.X、Y、Z三种元素形成的含氧酸都是强酸
D.一定条件下,X2与Al反应得到AlX
难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
A .D元素处于元素周期表中第3周期VIA族
B. 四种元素的原子半径:A<B<C<D
C. B、D的最高价氧化物具有相似的物理性质和化学性质
D. 一定条件下,B单质能置换出D单质,C单质能置换出A单质
难度: 中等查看答案及解析
-
下列图示的装置属于原电池的是 ( )

难度: 中等查看答案及解析
-
已知空气—锌电池的电极反应为:锌片:Zn+2OH-―2e-=ZnO+H2O;碳棒:O2+2H2O+4e- =4OH- ,据此判断,碳棒是 ( )
A.正极,被还原 B.正极,被氧化
C.负极,被还原 D.负极,被氧化
难度: 中等查看答案及解析
-
13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖。下面有关叙述正确的是( )
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N 与14N 互为同位素 D.232Th转化成233U是化学变化
难度: 中等查看答案及解析
-
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )

A .该反应是吸热反应
B. 断裂1molA﹣A键和1molB﹣B键可放出xkJ能量
C. 断裂2molA﹣B键需要吸收ykJ能量
D. 2molAB的总能量高于1molA2和1molB2的总能量
难度: 简单查看答案及解析
-
下列化学用语使用正确的是( )
A.NH4Cl的电子式:
B.用电子式表示氯化氢分子的形成过程:
C.氧化钠的电子式:
D.R2+离子核外有a个电子,b个中子,R原子表示为:
难度: 中等查看答案及解析
-
高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O==3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是()
A.放电时正极反应为: Zn-2e-+2OH-=Zn(OH)2
B.该原电池,Zn作正极,可用石墨等作负极
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
难度: 中等查看答案及解析
-
能说明氯的非金属性比硫强的事实是( )
A.氯化氢的酸性强于硫化氢
B.氯化氢的稳定性比硫化氢强
C.氯气能与水反应而硫不能
D.氯原子最外电子层上有7个电子而硫最外电子层上有6个电子
难度: 中等查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d
B.氢化物的稳定性:H2Y>HZ
C.离子的氧化性: X+>W3+
D.原子半径:X<W
难度: 简单查看答案及解析
-
下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水⑤冰融化 ⑥NH4Cl受热“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
A. ①②④⑥⑦ B. ④⑥ C. ①④⑤⑧ D. ①②④⑤⑥⑦
难度: 简单查看答案及解析
-
下列物质中,既含有离子键又含有非极性键的是( )
A.CO2 B.MgCl2 C.Na2O2 D.KOH
难度: 简单查看答案及解析
-
将4 mol A气体和2mol B气体在2 L的密闭容器中混合,并在一定条件下发生如下反应2A(g)+B(g)
2C(g),反应2 s后测得C的浓度为0.6 mol/L。下列说法正确的是( )
A.用物质A表示2 s内的平均反应速率为0.3 mol/(L·s)
B.用物质B表示2s内的平均反应速率为0.6 mol/(L·s)
C..2 s后物质A的转化率为70%
D.2 s后物质B的浓度为0.35 mol/L
难度: 中等查看答案及解析
-
在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(
表示混合气体的平均相对分子质量)( )
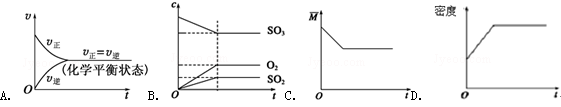
难度: 困难查看答案及解析
-
一定条件下,可逆反应X(g)+3Y(g)⇌2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
难度: 简单查看答案及解析