-
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置。下列各图中能用作防倒吸安全瓶的是

难度: 简单查看答案及解析
-
下列说法正确的是
A.4.2 g丙烯中所含的共价键数目为0.6×6.02×1023
B.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023
C.相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2
D.相同物质的量OH-和CH3+含有相同数目的电子
难度: 简单查看答案及解析
-
下列解释实验事实的反应方程式不正确的是
A.盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O
B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O
C.用KSCN溶液检验Fe3+:Fe3++3SCN-
Fe(SCN)3
D.酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH-
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.比例模型
可以表示水分子,也可以表示二氧化碳分子
B.电子式
可以表示羟基,也可以表示氢氧根离子
C.离子结构示意图
可以表示35Cl-,也可以表示37Cl-
D.离子方程式HCO3-+H2O
H3O+ +CO32-可以表示HCO3-离子的水解,也可以表示它的电离
难度: 简单查看答案及解析
-
绿原酸的结构简式如图,下列有关绿原酸的说法不正确的是
A.分子式为C16H18O9
B.能与Na2CO3反应
C.能发生取代反应和消去反应
D.0.1 mol绿原酸最多与0.8 mol NaOH反应
难度: 简单查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A.pH=2的溶液: Fe3+、Cu2+、SO42-、NO3-
B.c(H+)=1×10-12mol/L的溶液:NH4+、K+、Cl-、AlO2-
C.水电离的c(H+)=1×10-12mol/L的溶液:Na+、Al3+、Br-、ClO-
D.与铝反应放出氢气的溶液:Na+、Mg2+、Br-、Cl-
难度: 简单查看答案及解析
-
标准状态下,在四个干燥的烧瓶中分别充入:① 纯净的氨气,② 混有1/3体积空气的氯化氢气体,③ 纯净的NO2气体,④ 混有少量O2的NO2气体。然后各做喷泉实验。实验后,三烧瓶中溶液的物质的量浓度大小关系是
A. ①=②=③=④ B. ①=②=③>④ C. ①=②=③<④ D. ④>①=②>③
难度: 中等查看答案及解析
-
关于下图所示的原电池,下列说法正确的是
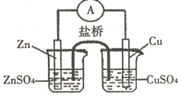
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.取出盐桥后,电流计的指针仍发生偏转
D.铜电极上发生的电极反应是2H+ + 2e- = H2↑
难度: 简单查看答案及解析
-
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是
A.分别升高温度,两种溶液的pH均减小
B.相同温度下两种溶液的pH:Na2CO3> NaHCO3
C.分别加少量NaOH,两液c(CO32-)均增大
D.两液均存在c(Na+) + c(H+)=c(OH-) + c(HCO3-) + 2c(CO32-)
难度: 简单查看答案及解析
-
在一密闭容器中充入1molNO2气体,建立如下平衡2NO2
N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
A.a>b B.b>a C.a=b D.无法比较
难度: 简单查看答案及解析
-
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y
B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH >Ba(OH)2
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A.46 g乙醇中含有的化学键数为7 NA
B.1 mol氯气和足量NaOH溶液反应转移电子数为2 NA
C.1 mol OH- 和1 mol -OH(羟基)中含有的质子数均为 9 NA
D.10 L 0.1 mol·L-1 的Na2CO3溶液中,Na+、CO32- 总数为3 NA
难度: 简单查看答案及解析
-
常温下,下列各组比值为1∶2的是
A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比
B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比
C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比
难度: 简单查看答案及解析
-
下列相关反应的离子方程式书写正确的是
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O
B.硫酸铜溶液显酸性:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-
NH3↑+H2O
D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2 = 2Mn2++5O2↑+8H2O
难度: 简单查看答案及解析
-
下列实验方案不可行或结论不正确的是
A.用润湿的pH试纸测定饱和Na2CO3溶液pH
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀
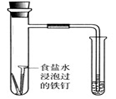
C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2
D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸
难度: 中等查看答案及解析
-
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是
A.热稳定性:H2Y<HZ B.原子半径:W>X>Z>Y
C.离子半径:W2+>Y2- D.碱性:XOH<W(OH)2
难度: 简单查看答案及解析
-
将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如下图,符合图中情况的一组物质是( )。
A B C D
X H2S HCl NH3 NH3·H2O
Y Na2SO3 NaAlO2 AlCl3 AgNO3
难度: 中等查看答案及解析
-
下列化学反应的离子方程式不正确的是
A.Na2S溶液中加入少量FeCl3溶液:2Fe3++S2- = 2Fe2++S↓
B.向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3- = CaCO3↓+2H2O+CO32-
C.向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O = SO42-+Cl-+2H+
D.Na2CO3溶液中滴入少量邻羟基苯甲酸溶液:
+CO32-
+HCO3-
难度: 简单查看答案及解析
-
下列关于0.1 mol·L-1CH3COONa溶液的说法正确的是 ( )
A.加入少量NaOH固体,c(CH3COO-)增大
B.加入少量FeCl3固体,c(CH3COO-)增大
C.稀释溶液,溶液的pH增大
D.加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)
难度: 简单查看答案及解析
-
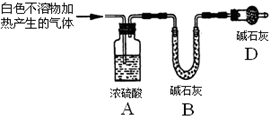
下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是 ( )
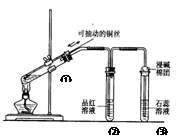
A.上下移动①中铜丝可控制SO2的量
B.②中品红溶液不褪色
C.③中石蕊溶液变蓝色
D.为确认CuSO4生成,向①中加水,观察溶液颜色
难度: 简单查看答案及解析
-
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为2:1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1:10 B.1:8 C.1:6 D.1:5
难度: 简单查看答案及解析
-
室温下,往0.1mol/L的氨水中滴入酚酞试液时,溶液将呈现粉红色。现采取下列措施,滴有酚酞的氨水溶液颜色不会变浅的是
A、往溶液中滴入稀硫酸 B、往溶液中加入NH4Cl晶体
C、把溶液加热至沸腾 D、往溶液中加入NaOH固体
难度: 简单查看答案及解析
-
下述实验不能达到预期实验目的的是
序号 实验内容 实验目的
A 将2.5g CuSO4·5H2O溶解在97.5g 水中 配制质量分数为1.6%的CuSO4溶液
B 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 说明一种沉淀能转化为另一种溶解度更小的沉淀
C 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH 比较HClO和CH3COOH的酸性强弱
D 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 研究浓度对反应速率的影响
难度: 简单查看答案及解析
-
密闭容器中,反应xA(g)+yB(g)
zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是 ( )
A.x+y>z B.平衡向正方向移动
C.B的转化率降低 D.C的体积分数下降
难度: 简单查看答案及解析
-
香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下图所示。下列说法正确的是( )
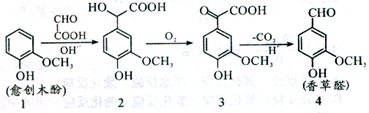
A.理论上反应1→2中原子利用率为100%
B.化合物2不能发生缩聚反应
C.检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D.等物质的量的四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:3:2:4
难度: 中等查看答案及解析