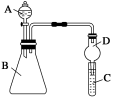
-
日本福岛核电站的核原料铀235(235 92U)裂变释放出具有放射性的碘131(I)和铯137(Cs),下列说法正确的是
A.127I与131I互为同素异形体 B.137Cs的核电荷数为137
C.铀235的中子数是143 D.铯与水的反应比钠与水的反应缓慢
难度: 简单查看答案及解析
-
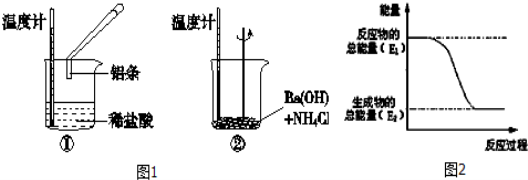
下列叙述正确的是
A.化学反应一定只伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量
难度: 中等查看答案及解析
-
100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
A.①③ B.②③ C.①④ D.②④
难度: 中等查看答案及解析
-
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是
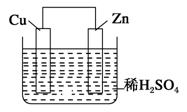
①Zn为正极,Cu为负极;②H+向负极移动;③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;⑤若有1 mol电子流过导线,则理论上产生H2 0.5 mol;
⑥正极的电极反应式为Zn-2e-= Zn2+。
A.③④⑤ B.①②③ C.④⑤⑥ D.②③④
难度: 中等查看答案及解析
-
下列电子式正确的是
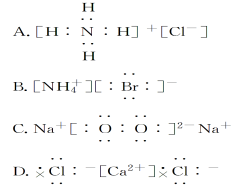
难度: 中等查看答案及解析
-
参照反应Br+H2
HBr+H的能量对反应历程的示意图。下列叙述正确的是
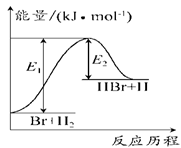
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
向某一固定体积的密闭容器中充入NO2,在一定条件下进行反应:2NO2
2NO+O2。达到平衡状态的标志是
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1
A.①② B.③④ C.①④ D.②③
难度: 中等查看答案及解析
-
下列每组物质中含有的化学键类型相同的是
A.NaCl HCl H2O NaOH B.Cl2 Na2S HCl CO2
C.HBr CCl4 H2O CO2 D.Na2O2 H2O2 H2O O2
难度: 中等查看答案及解析
-
NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g)
2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后反应达到平衡,测得生成的H2O占混合气体总体积的40%,则下列表示此段时间内该反应的平均速率不正确的是
A.v(N2)=0.125 mol·L-1·min-1 B.v(H2O)=0.375 mol·L-1·min-1
C.v(O2)=0.225 mol·L-1·min-1 D.v(NH3)=0.250 mol·L-1·min-1
A.①② B.③④ C.①④ D.②③
难度: 中等查看答案及解析
-
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
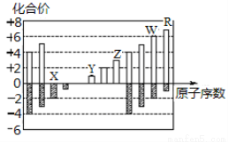
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R<W
C.WX3和水反应形成离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3=c kJ·mol-1
则反应CO2(g)+CH4(g)
2CO(g)+2H2(g)的△H用含a、b、c的代数式表示为
A.a+2b-c B.a+b-2c C.2a+2b-c D.a+2b-2c
难度: 困难查看答案及解析
-
根据下列事实:①A+B2+═A2++B;②E+2H2O═E(OH)2↓+H2↑;③以B、D为电极与D的盐溶液组成原电池,电极反应为:D2++2e﹣═D,B﹣2e﹣═B2+.由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是
A.D2+>B2+>A2+>E2+ B.B2+>A2+>D2+>E2+
C.D2+>E2+>A2+>B2+ D.E2+>B2+>A2+>D2+
难度: 中等查看答案及解析
-
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l) = Zn(OH)2(s)+Mn2O3(s)。下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e- = Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
难度: 中等查看答案及解析
-
核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。下列有关元素X的说法中,不正确的是
A.元素X的原子核内质子数为(2a2-1)
B.元素X的原子半径一定小于钠的原子半径
C.由元素X形成的某些化合物,可能具有杀菌消毒的作用
D.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)
难度: 中等查看答案及解析
-
已知断开1mol H2中的化学键需要吸收436kJ的能量,断开1mol Cl2中的化 学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学键要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为
A.吸收183kJ B.吸收366kJ C.放出183kJ D.放出366kJ
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21,下列说法正确的是
A.Y的气态氢化物在一定条件下可被Q单质氧化
B.Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同
C.Q可分别与X、Y、Z、W形成化学键类型相同的化合物
D.Y的简单离子半径小于Z的简单离子半径
难度: 困难查看答案及解析