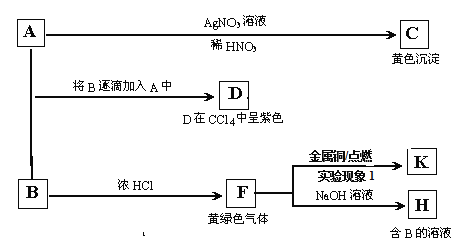
-
用下列试剂或方法不能鉴别NaOH溶液和KC1溶液的是
A. 紫色石蕊试液 B. Ba(NO3)2溶液 C. CuCl2溶液 D. 焰色反应
难度: 简单查看答案及解析
-
下列叙述中正确的是
A. 气体摩尔体积是指1 mol任何气体所占体积约为22.4 L
B. 配制1 mol•L-1 NaCl溶液 1 L,其方法是将58.5 g NaCl溶于1 L 水中
C. 1 mol NH3中约含有6.02×1024个电子
D. 1molO2的质量是32 g• mol-1
难度: 简单查看答案及解析
-
金华市金东区环保部门为了使农村生活垃圾得到合理利用,在全国率先实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶制品等属于
A. 无机物 B. 有机物 C. 盐类 D. 非金属单质
难度: 简单查看答案及解析
-
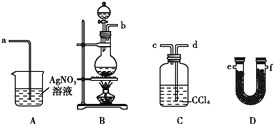
仪器名称为“容量瓶”的是
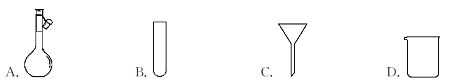
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列属于电解质的是
A. 氯气 B. 金属铝 C. 氯化钠 D. 汽油
难度: 简单查看答案及解析
-
下列各组物质中,互为同位素的是
A. 40Ca和40Ar B. D和T C. H2O和H2O2 D. 红磷和白磷
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 工业上可以用电解饱和食盐水制备氯气
B. 钠是一种强还原剂,可以把钛、锆、铌、钽等从其熔融盐中置换出来
C. 常温下钠和钾的合金为液态,可作快中子反应堆的导热剂
D. Cl2和NaCl中均含有氯元素,它们的化学性质相同
难度: 简单查看答案及解析
-
带有2个单位正电荷的微粒X2+,它的质量数等于137,中子数是81,则核外电子数为
A. 56 B. 54 C. 58 D. 137
难度: 简单查看答案及解析
-
我国的自来水一般是用氯气消毒的。某学生用这种自来水配制下列物质溶液,不会产生明显的药品变质的是
A. AgNO3 B. KI C. Na2CO3 D. FeCl3
难度: 简单查看答案及解析
-
用漂白粉溶液浸泡过的有色布条,如晾置在空气中,过一段时间,其漂白效果更好的原因
A. 漂白粉被氧化了
B. 有色布条被空气中的氧气氧化了
C. 漂白粉和空气中的二氧化碳充分反应生成了次氯酸
D. 漂白粉溶液蒸去了部分水分,其浓度增大了
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. NA个氧分子与NA个氢分子的质量之比为8︰1
B. 标准状况下,2.24 LCCl4含有的原子数目为0.5 NA
C. 室温下,1 L 0.1 mol•L-1的H2S04溶液中,H2S04电离出0.2NA个H+
D. 将1 mol Cl2通入H2O中,生成NA个HC1O分子
难度: 简单查看答案及解析
-
有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3,有四位同学为鉴别它们采用以下不同方法,其中可行的是
A. 分别将它们配制成溶液,再加入澄清石灰水
B. 分别将它们配制成溶液,再加入NaOH溶液
C. 将它们配制成溶液,再分别加到盐酸中
D. 分别加热,再用石灰水检验是否有CO2产生
难度: 简单查看答案及解析
-
下列反应中,水只作氧化剂的氧化还原反应是
A. 3Fe+4H2O(g)
Fe3O4+4H2 B. 2Na2O2+2H2O=4NaOH+O2↑
C. 2F2+2H2O=4HF+O2 D. Cl2 + H2O ⇌ HCl + HClO
难度: 简单查看答案及解析
-
对下列实验过程的评价,正确的是
A. 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成不溶于稀HNO3的白色沉淀,证明一定含有SO42—
C. 某无色溶液滴入Na2CO3试液产生白色沉淀,该溶液一定是Ca(OH)2溶液
D. 验证烧碱溶液中是否含Cl—,先加稀HNO3除去OH—,再加入AgNO3溶液,有白色沉淀,证明含Cl—
难度: 中等查看答案及解析
-
下列说法正确的是
A. 同温同压下,等质量的甲烷比氖气所占有的体积小
B. 3.01×1023个X气体分子的质量为16g,则X气体的摩尔质量是64 g• mol-1
C. 0.5L 1 mol•L-1 FeCl3溶液与0.2L 1 mol•L-1 KCl溶液中的Cl—的数目之比为15: 2
D. 150ml 1 mol•L-1NaCl溶液与50ml 1 mol•L-1AlCl 3溶液中Cl—物质的量浓度相等
难度: 简单查看答案及解析
-
已知:2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O,K2Cr2O7+14HCl(浓)2KCl+2CrCl3+3Cl2↑+7H2O, MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,其中KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(大于6 mol•L-1)反应,MnO2需和浓盐酸(大于8 mol•L-1)反应。根据以上信息,下列结论中不正确的是
A. 上述反应都属于氧化还原反应 B. 生成1 mol Cl2转移电子数均为2NA
C. 盐酸浓度越大,Cl—的还原性越强 D. 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2
难度: 简单查看答案及解析
-
某温度下,将氯气通入氢氧化钠溶液中,反应得到氯化钠、次氯酸钠、氯酸钠的混合液,经测定溶液中次氯酸钠和氯酸钠的浓度之比为1 :3,则氯气与氢氧化钠溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A. 21 :5 B. 4 :1 C. 3 :1 D. 11 :3
难度: 中等查看答案及解析
 B.
B.  C.
C.  D.
D.