-
已知:101kPa时,辛烷的燃烧热为5518kJ·mol-1,强酸与强碱在稀溶液中发生反应时的中和热为57.3kJ·mol-1,则下列热化学方程式书写正确的是 ( )
① C8H18(l)+
O2(g)= 8CO2(g)+9H2O(g);△H = -5518kJ·mol-1
② C8H18(l)+
O2(g)= 8CO2(g)+9H2O(l);△H = -5518kJ·mol-1
③ H+ + OH- = H2O;△H = -57.3kJ·mol-1
④ NaOH(aq)+
H2SO4(aq)
Na2SO4(aq)+H2O(l);△H= +57.3kJ·mol-1
A.①③ B.② C.②④ D.②③
难度: 中等查看答案及解析
-
下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中c(H+)=10-13mol/L时,又能生成沉淀。该组离子可能是 ( )
A.Na+、Cu2+、NO3-、CO32- B.Al 3+、K+、Cl-、HCO3-
C.Fe2+、 Na+、SO42-、NO3- D.Mg2+ 、NH4+、SO42-、Cl-
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.常温常压下,100g98%磷酸溶液中含有的氧原子数为4NA
B.标准状况下,当活泼金属转移2NA个电子时,可从盐酸中置换产生44.8LH2
C.15gCH3+中含有的电子数为0.8NA
D.1molH2O2分子中非极性共价键数为NA
难度: 中等查看答案及解析
-
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe=Sb4O6+6FeS ……………………①
Sb4O6+6C=4Sb+6CO ………………………②
关于反应①、反应②的说法正确的是 ( )
A.反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3 mol FeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
难度: 中等查看答案及解析
-
在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述正确的是( )
A.白色沉淀是BaSO4和BaSO3 B.溶液的酸性减弱
C.白色沉淀是BaSO3 D.FeCl3全部被还原为FeCl2
难度: 中等查看答案及解析
-
取少量无机盐溶液试样对其中的离子进行检验。下列判断正确的是 ( )
A.加入盐酸,产生白色沉淀,则试样中一定有Ag+
B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-[ ]
C.加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则试样中一定有SO42
D.加入NaOH溶液微热,产生能使湿润的红色石蕊试纸变蓝的气体,则试样中一定有NH4+
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是 ( )
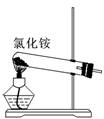

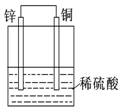
① ② ③ ④
A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是原电池,锌电极为负极,发生还原反应
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是 ( )
A.过量的CO2通入Ca(ClO)2溶液中 2ClO-+CO2+H2O=CO32-+2HClO
B.AgNO3溶液滴入少量的Na2S溶液 2Ag++S2-=Ag2S↓
C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O
D.向Ba(OH)2溶液中加入少量的NaHSO3溶液
2HSO3-+Ba2++2OH-=BaSO3↓+SO32-+2H2O
难度: 中等查看答案及解析
-
.将a g无水Na2CO3溶于t℃的饱和Na2CO3溶液中,析出b g晶体,则(b-a) g表示的含义是 ( )
A.减少的饱和溶液的质量 B.饱和溶液失去溶质Na2CO3的质量
C.析出Na2CO3·10H2O的质量 D.饱和溶液失去水的质量
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A.电解法精炼铜时,电解质溶液中铜离子浓度一定不变
B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其正极上发生的反应为:
CH3OH-6e- +8OH- =CO32-+6H2O
C.在铁上镀铜时,金属铜作阴极
D.溶液、胶体和悬浊液三种分散系的本质区别是分散质微粒直径的大小
难度: 中等查看答案及解析
-
不活泼金属不能与非氧化性酸发生自发的置换反应,但某学生喜欢探究欲完成
2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是 ( )
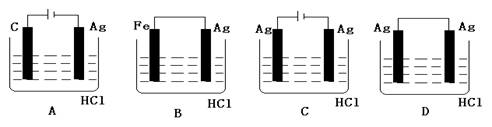
难度: 中等查看答案及解析
-
美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50W的电力。一极通人空气,另一极通人丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,下列对该燃料电池的说法不正确的是( )
A.电路中每流过5mol电子,肯定有5.6 L丙烷被完全氧化
B.该电池的总反应是:C3H8+5O2→3CO2+4H2O
C.在熔融电解质中,O2-由正极移向负极
D.通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-=3CO2 +4H2O
难度: 中等查看答案及解析
-
某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子组是 ( )
A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
难度: 中等查看答案及解析
-
已知
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:

则表中a为 ( )
A.404 B.260 C.230 D.200
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,当下列物理量不再改变时,不能表明反应:
A(s)+2B(g)
C(g)+D(g)已达平衡的是: ( )
A.混合气体的平均摩尔质量 B.混合气体的密度
C.A物质的质量 D.气体的总物质的量
难度: 中等查看答案及解析
-
有如下的可逆反应:X(g)+2Y(g)
2Z(g) 现将X和Y以1︰2的体积比混合在密闭容器中,加压到3×107Pa,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是( )
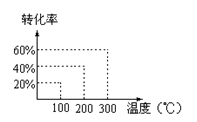
A.100℃
B.200℃
C.300℃
D.不能确定
难度: 中等查看答案及解析
-
10℃时,某化学反应A→C的反应速率vA=0.1mol·L-1·S-1,若温度每升高10℃,反应速率增加到原来的2倍,若要使vA=1.6 mol·L-1·S-1,则反应温度应控制在( )
A.30℃ B.40℃ C.50℃ D.60℃
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
⑤钠与氯化钾共融制备钾Na(1)+KC1(1)
K(g)+NaC1(1);
⑥二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
A.①②③ B.②⑥ C.③④⑤ D.②⑤⑥
难度: 中等查看答案及解析
-
用来表示可逆反应:2A(g)+B(g)
2C(g) △H<0 的正确图象是下图中的( )
A B C D
难度: 中等查看答案及解析
-
如右图,关闭活塞K,向A充入1molX、1molY,向B中充入2molX、2molY,起始时A.B的体积相等都等于a L,在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)
2Z(g)+W(g);ΔH<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是 ( )

A.平衡时Y体积分数: B.A容器中X的转化率为80%
C.平衡时的压强:PB>2PA D.A>B反应速率:v(B)>v(A)
难度: 中等查看答案及解析