-
氯在自然界以化合物形态存在,18世纪70年代,首先发现并制得氯气的化学家是
A.汤姆生 B.舍勒 C.阿伏加德罗 D.卢瑟福
难度: 简单查看答案及解析
-
据报道,元素钬有一种放射性核素
可有效治疗肝癌。该核素原子核内的中子数为
A.67 B.99 C.166 D.233
难度: 简单查看答案及解析
-
化合物的分类中,Na2CO3属于
A.氧化物 B.酸 C.碱 D.盐
难度: 简单查看答案及解析
-
光导纤维的主要成分是
A.Si B.SiO2 C.SiC D.Na2SiO3
难度: 简单查看答案及解析
-
下列物质中,属于强电解质的是
A.Cu B.H2O . C.H2SO4 D.CH3COOH
难度: 简单查看答案及解析
-
下列物质所对应的化学式不正确的是
A.干冰——CO2 B.硫化亚铁——FeS2 C.苏打——Na2CO3 D.重晶石——BaSO4
难度: 简单查看答案及解析
-
常温下以下四种金属分别投入浓硫酸、浓硝酸、浓盐酸、浓氢氧化钠溶液四种溶液,其中只能与两种溶液发生剧烈反应,并产生气体的金属是
A.铁 B.铜 C.银 D.铝
难度: 简单查看答案及解析
-
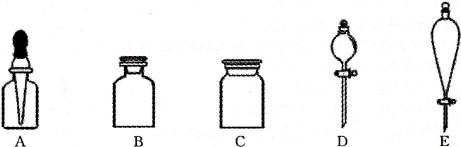
下列仪器常用于物质分离的是

A.③⑤⑥ B.②③⑤ C.②④⑤ D.①②⑥
难度: 简单查看答案及解析
-
胶体区别于其它分散系的本质特征是
A.分散质粒子直径在1nm~100nm之间
B.产生丁达尔现象
C.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
D.胶体在一定条件下能稳定存在
难度: 简单查看答案及解析
-
下列有关物质的保存方法,不正确的是
A.液氯储存在钢瓶中
B.浓硝酸储存在铝制容器中
C.金属钠保存在煤油中
D.氢氧化钠溶液保存在带玻璃塞的玻璃试剂瓶中
难度: 简单查看答案及解析
-
下列氧化还原反应中,电子得失情况表示不正确的是
A.
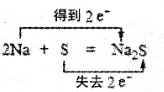 B.
B.
C.
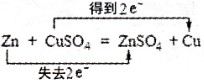 D.
D.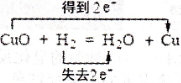
难度: 简单查看答案及解析
-
能大量共存于某无色透明溶液中的离子组是
A.Ag+、N
、Clˉ B.Mg2+、
、Clˉ
C.Cu2+、Na+、S
D.Na+、H+、HC
难度: 简单查看答案及解析
-
氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:
Al2O3+N2+3C
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41 g
难度: 简单查看答案及解析
-
在相同温度和压强下,等质量的下列气体所占体积最大的是
A.H2 B.O2 C.CO2 D.Cl2
难度: 简单查看答案及解析
-
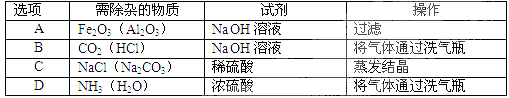
除去下列括号内的杂质,所加试剂和操作均正确的是
难度: 简单查看答案及解析
-
用下列实验装置能达到实验目的的是

A.验证NaHCO3和Na2CO3热稳定性大小 B.用铜和稀硝酸制取并收集少量NO
C.验证明氨气的溶解性大小 D.实验室用氯化铵制少量氨气
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.硫酸溶液中滴加氢氧化钡溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.过量CO2通入Ca(ClO)2溶液中:CO2+H2O+Ca2++2ClO-=CaCO3↓+2HClO
C.向FeCl3溶液中加入铜粉:2Fe3++Cu=Cu2++2Fe2+
D.氢氧化铜加到醋酸溶液中:Cu(OH)2+2H+=Cu2++2H2O
难度: 简单查看答案及解析
-
将SO2气体通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体仍无沉淀产生。则通入的该气体可能是
A.CO2 B.NH3 C.NO2 D.Cl2
难度: 简单查看答案及解析
-
有关Na2CO3和NaHCO3的叙述中正确的是
A区别NaHCO3与Na2CO3溶液,Ca(OH)2溶液和CaCl2溶液均可用 .
B.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
C.NaHCO3的溶解度比Na2CO3的大
D.Na2CO3固体中混有NaHCO3,高温灼烧即可
难度: 简单查看答案及解析
-
下列有关物质性质实验的叙述,正确的是
A.钠在空气中燃烧,生成淡黄色的氧化钠粉末
B.镁在二氧化碳中燃烧,生成白色的氧化镁和黑色的炭
C.将灼热的铁丝放人盛有氯气的集气瓶中,生成棕黄色的氯化铁烟雾
D.在铜和浓硫酸加热反应后的混合液中加水,得到无色硫酸铜溶液
难度: 简单查看答案及解析
-
下列叙述正确的是
A.工业上用氯气通人纯碱溶液来生产漂白粉
B.工业制硫酸的生产过程中,硫元素的转化步骤是:FeS2
SO3
H2SO4
C.高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁
D.在海水中加人石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2 L H2O屮所含的分子数为0.5 NA
B.常瘟下,32 g O3中所含的原子数为2 NA
C.1 mol·L-1NaOH溶液中所含Na+离子数为NA
D.5.6 g Fe与2.24 L Cl2充分反应,转移的电子数为0.2 NA
难度: 简单查看答案及解析
-
等体积、等物质的量浓度的稀盐酸和氢氧化钠溶液与足量的铝粉反应,产生氢气的质量比是
A.1:1 B.1:2 C.1:3 D.3:1
难度: 简单查看答案及解析
-
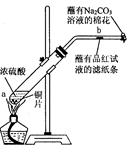
如图所示,从a处通入氯气。若打开活塞b,d处的有色布条不褪色;若关闭活塞b,d处的有色布条褪色。下列判断正确的是
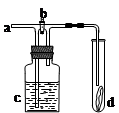
A.a处通入的是潮湿的氯气 B.c中盛放的可能是浓硫酸
C.c中盛放的可能是氢氧化钠溶液 D.c中盛放的可能是饱和食盐水
难度: 简单查看答案及解析
-
向含等物质的量两种溶质的甲溶液逐渐加人乙物质,生成不溶物的量(Y)与加人物的量(X)之间的关系符合图所示的是
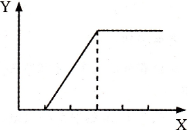
甲溶液 乙物质
A NaOH和Ca(OH)2 CO2气体
B H2SO4和MgSO4 NaOH溶液
C HCl和CaCl2 Na2CO3溶液
D Fe2(SO4)3和CuSO4 Fe粉
难度: 中等查看答案及解析