-
蒸馒头、炸油条时常用到一种白色物质,它既能中和发酵过程产生的酸,又能引起发泡 作用,这种白色物质是 ( )
A.NaOH B.Ca(OH)2 C.NaHCO3 D.NaCl
难度: 极难查看答案及解析
-
下列关于化学学习和研究的说法中,错误的是 ( )
A.化学模型有助于解释一些化学现象 B.质量守恒定律是大量试验事实的总结
C.化学家提出的假设都能被试验证明 D.化学基本原理的应用是有一定条件的
难度: 极难查看答案及解析
-
下列各组物质或概念之间,不符合右图所示关系的是 ( )
X
Y
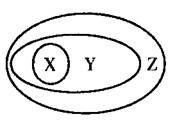 Z
ZA
硫酸
含氧酸
酸
B
胶体
分散系
混合物
C
电解质
化合物
纯净物
D
酸性氧化物
非金属氧化物
氧化物
难度: 极难查看答案及解析
-
下列说法不正确的是 ( )
A.实验室制备NH3可用NaOH固体和浓氨水为原料方便制得
B.二氧化硅是生产光纤制品的基本原料
C.工业制水泥、玻璃、陶瓷都要用到石灰石为原料
D.工业上可利用铝热反应原理制备高熔点金属
难度: 极难查看答案及解析
-
过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是 ( )
A.Na2 SO3溶液 B.KmnO4溶液
C.稀盐酸 D.MnO2
难度: 极难查看答案及解析
-
下列实验操作或实验所得出的结论一定正确的是 ( )
A.加热NH4 Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成
B.制备Fe(OH)2胶体时,应往沸水中逐滴加1mol·L-1的FeCl3溶液,并继续加热到 液体呈透明的红褐色为止
C.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
D.用托盘天平准确称取5. 85克NaCl
难度: 极难查看答案及解析
-
下列实验过程中,始终无明显现象的是 ( )
A.NO2通人FeSO4 溶液中 B.CO2通人CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通人已酸化的Ba(NO3)2溶液中
难度: 极难查看答案及解析
-
下列叙述正确的是 ( )
A.元素由化合态变成游离态时,它可能被氧化,也可能被还原
B.SO2的水溶液能导电,所以SO2是电解质
C.难失电子的原子,得电子的能力一定强
D.在氧化还原反应中,有一种元素被氧化,肯定有另一种元素被还原
难度: 极难查看答案及解析
-
下列化学应用中不涉及氧化还原反应的是 ( )
A.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
B.工业上制取单质硅
C.Na2O2作呼吸面具中的供氧剂
D.一定条件下用硫酸铜制CuH
难度: 极难查看答案及解析
-
下列反应的离子方程式正确的是 ( )
A.NH4HCO3溶液与过量NaOH溶液反应:NH+4+OH-=NH3↑+H2O
B.铜溶解于稀硝酸中:Cu+4H++2NO-3=Cu2++2NO2↑+2H2O
C.向氨水中滴入盐酸:H++OH-=H2O
D.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO-3+Ba2++OH-=BaCO3↓+H2O
难度: 极难查看答案及解析
-
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )
A.Al2、SO2、CO2、SO3 B.Cl2、Al2O3、N2O5、SO3
C.CO2、Cl2、CaO、SO3 D.SiO2、N2O5、CO、Cl2
难度: 极难查看答案及解析
-
关于下列实验装置说法中正确的是 ( )

A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C用图③可以检验火柴燃烧生成的SO2气体
D.用图④提取海带中的碘
难度: 极难查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列说法中正确的是 ( )
A.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子
B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
C.0.1mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15NA
D.VLCO和NO的混合气体中含有的氧原子个数为
难度: 极难查看答案及解析
-
下列有关离子大量共存的说法正确的是 ( )
A.H+、Fe2+、SO-3、NO-3因发生氧化还原反应而不能大量共存
B.澄清透明的无色溶液中,ClO-、MnO-4、Al3+、SO2-4可能大量共存
C.在含大量Fe3+的溶液中,NH+4、Na+、Cl-、SCN-可能大量共存
D.使石蕊试液变红的溶液中,Na+、Cl-、SO2-4、HCO-3可以大量共存
难度: 极难查看答案及解析
-
在含2 mol H2 SO4的浓H2 SO4溶液中加入足量的Zn粉,使其充分反应,则下列推断中错误的是 ( )
①放出的气体中除SO2外还有H2;
②反应结束时转移电子的总韧质的量为4 mol;
③只放出SO2气体,其物质的量为l mol;
④反应结束后加入KNO3固体,Zn粉继续溶解
A.只有① B.只有② C.只有③④ D.只有②③④
难度: 极难查看答案及解析
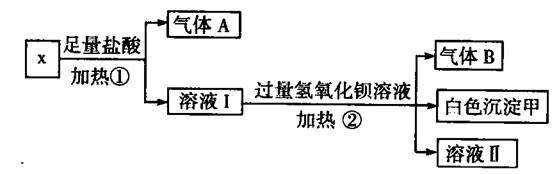


 (4)在实验室模拟上述实验过程中,需要用到一定浓度的盐酸溶液。在配制250mi。该盐酸溶液时,某同学转移溶液的操作如图所示,图中的主要
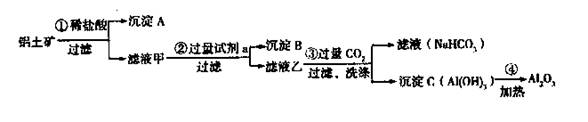
(4)在实验室模拟上述实验过程中,需要用到一定浓度的盐酸溶液。在配制250mi。该盐酸溶液时,某同学转移溶液的操作如图所示,图中的主要 (4)准确称取6g铝土矿样品,加入100mL盐酸溶液,充分反应后向滤液中加入10 mol·L-1试剂a的溶液,产生沉淀的质量与加入试剂a的体积关系如图所示,则所用盐酸溶液的物质的量浓度为________,样品中Al2O3的百分含量为________。
(4)准确称取6g铝土矿样品,加入100mL盐酸溶液,充分反应后向滤液中加入10 mol·L-1试剂a的溶液,产生沉淀的质量与加入试剂a的体积关系如图所示,则所用盐酸溶液的物质的量浓度为________,样品中Al2O3的百分含量为________。