-
下列设备工作时,将化学能转化为热能的是
A
B
C
D




硅太阳能电池
锂离子电池
太阳能集热器
燃气灶
难度: 中等查看答案及解析
-
氢气是人类未来最理想的燃料,以水为原料大量制取氢气的最理想的途径是
A.利用太阳能直接使水分解产生氢气
B.以焦炭和水制取水煤气(含CO和H2)后分离出氢气
C.用铁和盐酸反应放出氢气
D.由热电站提供电力电解水产生氢气
难度: 中等查看答案及解析
-
关于能源,以下说法中不正确的是
A.煤、石油、天然气等燃料属不可再生能源
B.煤、石油、水煤气可从自然界直接获取,属一级能源
C.太阳能是一级能源、新能源、可再生能源
D.潮汐能来源于月球引力做功
难度: 中等查看答案及解析
-
下列关于燃烧热的说法中正确的是
A.1 mol物质燃烧所放出的热量
B.常温下,可燃物燃烧放出的热量
C.在25°C、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随热化学方程式中的化学计量数的改变而改变
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.化石燃料在任何条件下都能充分燃烧
B.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C.直接燃烧不如将煤进行深加工后再燃烧的效果好
D.固体煤变为气体燃料后,燃烧效率将更高
难度: 中等查看答案及解析
-
能源紧张、资源短缺、环境恶化是当今世界面临的三大问题,下列说法错误的是
A.电池外壳的金属材料回收再利用
B.将地沟油回收再加工为食用油,提高资源的利用率
C.目前我国使用的主要能源是化石燃料,化石燃料属于不可再生能源
D.能源的开发和利用情况,可以衡量一个国家或地区的经济发展和科学技术水平
难度: 中等查看答案及解析
-
“能源分类相关图”如图所示,四组能源选项中全部符合图中阴影部分的能源是
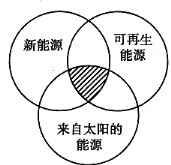
A.煤炭、石油、沼气
B.水能、生物能、天然气
C.太阳能、风能、潮汐能
D.地热能、海洋能、核能
难度: 中等查看答案及解析
-
下列说法中正确的是
A.在25℃、101 kPa时,1 mol纯物质完全燃烧时所放出的热量,叫作该物质的燃烧热
B.酸与碱发生中和反应生成1 mol水,这时的反应热叫做中和热
C.燃烧热和中和热都属于反应热
D.在稀溶液中,1 mol CH3COOH与1 mol NaOH完全中和时放出的热量为57.3 kJ
难度: 中等查看答案及解析
-
下列各组物质的燃烧热相等的是
A.1 mol C和2 mol CO
B.1 mol C和3 mol C
C.3 mol C2H2和1 mol C6H6
D.1 mol淀粉和1 mol纤维素
难度: 中等查看答案及解析
-
已知(1)HCl(aq)和NaOH(aq)反应的中和热△H=−57.3 kJ • mol−1;
(2)CO(g)的燃烧热是283.0 kJ • mol−1。则下列描述正确的是
A.H2SO4(aq)和NaOH(aq)反应的中和热△H=2×(−57.3) kJ • mol−1
B.2CO2(g)
2CO(g)+O2(g) △H=2×(+283.0) kJ • mol−1
C.
H2SO4(aq,浓)+ NaOH(aq)
Na2SO4(aq)+H2O(l) △H=−57.3 kJ • mol−1
D.1 mol甲烷燃烧所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
下列热化学方程式中,ΔH表示可燃物的燃烧热的是
A.H2(g)+Cl2(g)
2HCl(g) ΔH=−184.6 kJ·mol−1
B.CH4(g)+2O2(g)
CO2(g)+2H2O(g) ΔH=−802.3 kJ·mol−1
C.2H2(g)+O2(g)
2H2O(l) ΔH=−571.6 kJ·mol−1
D.CO(g)+1/2O2(g)
CO2(g) ΔH=−283 kJ·mol−1
难度: 中等查看答案及解析
-
已知:
①25 ℃、101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=−221 kJ·mol−1
②稀溶液中,H+(aq)+OH−(aq)===H2O(l) ΔH=−57.3 kJ·mol−1
又已知稀醋酸电离吸热。下列结论正确的是
A.C的燃烧热大于110.5 kJ·mol−1
B.①的反应热为221 kJ·mol−1
C.稀硫酸与稀NaOH溶液反应的中和热为−57.3 kJ·mol−1
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.已知H+(aq)+OH−(aq)===H2O(l) ΔH=−57.3 kJ·mol−1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(−57.3) kJ·mol−1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+
O2(g)===CO2(g)+2H2(g) ΔH=−192.9 kJ·mol−1,则CH3OH(g)的燃烧热为192.9 kJ·mol−1
C.H2(g)的燃烧热是285.8 kJ·mol−1,则2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol−1
D.葡萄糖的燃烧热是2 800 kJ·mol−1,则
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=−1 400 kJ·mol−1
难度: 中等查看答案及解析
-
煤的气化是实施节能环保的一项重要措施。通常在高温下将煤转化为水煤气,再将水煤气作为气体燃料。有关热化学方程式如下:
①C(s)+H2O(g)
CO(g)+H2(g) ΔH1=+131.3 kJ·mol−1
②2CO(g)+O2(g)
2CO2(g) ΔH2=−566.0 kJ·mol−1
③2H2(g)+O2(g)
2H2O(g) ΔH3=−483.6 kJ·mol−1
下列有关说法正确的是
A.水煤气只能用作燃料
B.水煤气是一种二级能源,比煤直接燃烧污染小
C.等质量的CO和H2完全燃烧时,前者放热多
D.由③反应可以确定H2的燃烧热为241.8 kJ·mol-1
难度: 中等查看答案及解析
-
已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=−Q1
②H2(g)+
O2(g)===H2O(g) ΔH2=−Q2
③H2(g)+
O2(g)===H2O(l) ΔH3=−Q3
常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为
A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2
C.0.4Q1+0.05Q3 D.0.4Q1+0.1Q3
难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)
CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+
O2(g)
CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是

A.CH3OH的燃烧热的ΔH=-192.9 kJ·mol-1
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+
O2(g)
CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
难度: 中等查看答案及解析


