-
化学与生活、社会密切相关。下列说法不正确的是
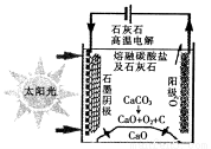
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.用废旧皮革生产药用胶囊可以提高原子利用率
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
难度: 简单查看答案及解析
-
下列化学用语描述中不正确的是
A.中子数为20的氯原子:
Cl
B.比例模型
可以表示CO2 分子或SiO2分子
C.HCO
的电离方程式为:HCO
+ H2O
CO
+H3O+
D.次氯酸的结构式:H-O-Cl
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.0.1mol —NH2(氨基)中含有的电子数目为1.0NA
B.常温下,1L 0.1mol·L-1 CH3COONa溶液中含有的CH3COO-和Na+总数为0.2NA
C.标准状况下,2.24 LH2O中含有的原子总数为3NA
D.常温常压下,16 g O2和O3混合气体含有的氧原子数为NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.酸、碱、盐都是电解质 B.电解质都是易溶于水的物质
C.氧化物都是电解质 D.氢化物都不是电解质
难度: 简单查看答案及解析
-
下列表示化学反应的离子方程式,其中正确的是
A.NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+= AI(OH)3
B.NH4HSO3溶液与足量浓NaOH溶液共热:NH4++HSO3-+2OH-
NH3↑+SO32-+H2O
C.明矾溶于水产生Al(OH)3 胶体: Al3++3H2O
Al(OH)3↓+3H+
D.FeCl3溶液与Cu反应:Fe3++Cu = Fe2++ Cu2+
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A.棉花、羊毛、蚕丝均属于天然纤维素
B.石油的分馏和裂化均属于化学变化
C.油脂都不能使溴的四氯化碳溶液褪色
D.甲烷、乙醇、乙酸在一定条件下都能发生取代反应
难度: 简单查看答案及解析
-
在一无色溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu2+ ②Fe3+ ③ Cl-④ NO3-⑤S2- ⑥CO32- ⑦ NH4+ ⑧Mg2+⑨Al3+ ⑩AlO2-离子。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
A.③⑤⑥⑦⑩ B.①②⑤⑥⑧⑨ C.③④⑦⑧⑨ D.①②③⑤⑥⑩
难度: 困难查看答案及解析
-
用下列实验装置和方法进行相应实验,能达到实验目的的是
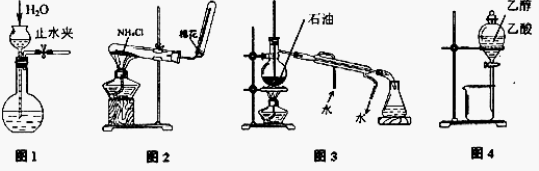
A.用图1所示方法检查装置的气密性
B.用图2所示装置和方法制取氨气
C.用图3所示装置和方法进行石油分馏
D.用图4装置和方法分离乙醇与乙酸
难度: 中等查看答案及解析
-
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2。有关它们的叙述 ①与水反应都是氧化还原反应;②与水反应后的溶液都显碱性;③与盐酸反应都只生成一种盐;④两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
A.①②③④ B.①②③ C.②③ D.②
难度: 中等查看答案及解析
-
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,
 则乙可能是
则乙可能是A.Al(OH)3 B.H2SiO3 C.FeCl2 D.CH3C1
难度: 中等查看答案及解析
-
下列说法正确的是
A.分散系中分散质粒子的大小:Fe (OH)3悬浊液<Fe (OH)3胶体<FeCl3溶液
B.可利用反应2CO=2C+O2(此反应
H>O、
S<0)来消除CO污染
C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB
D.除去Cu粉中混有的CuO,可加入稀硝酸中,充分反应后过滤、洗涤、干燥
难度: 中等查看答案及解析
-
有关实验的叙述,正确的是
A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小
难度: 简单查看答案及解析
-
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列说法不正确的是
A.在熔融电解质中,O2-向负极定向移动
B.电池的总反应是:2C4H10+13O2===8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+4e-===2O2-
D.通入丁烷的一极是负极,电极反应为:C4H10 +26e-+13O2-=== 4CO2↑+5H2O
难度: 中等查看答案及解析
-
100mL浓度为2mol·L-1的盐酸溶液跟过量的锌片反应,为减慢反应速率,又不影响生成H2的总量,可采用的方法有
A.加适量6mol·L-1HCl溶液
B.加数滴CuCl2溶液
C.加适量醋酸钠固体
D.加适量NaNO3溶液
难度: 简单查看答案及解析
-
X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述不正确的是
A.X与Y能形成两种常见的气态化合物
B.原子半径的大小顺序:r(Z)> r(R)> r(X) > r(Y)
C.X、Z分别与R形成的化合物中化学键类型不同
D.含有Y、Z、R三种元素的化合物最多只有2种
难度: 中等查看答案及解析
-
下列依据相关实验得出的结论正确的
A.SiO2既能与HF溶液反应,又能与NaOH溶液反应,说明SiO2是两性氧化物
B.用大理石和浓盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中,出现白色沉淀证明H2CO3的酸性比H2SiO3的酸性强
C.向某溶液中滴加硝酸酸化的Ba(NO3)2溶液产生白色沉淀,说明该溶液中含有SO42-
D.相同体积PH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强
难度: 中等查看答案及解析
-
下列陈述I、II正确并且有因果关系的是
选项
陈述I
陈述II
A
SO2和氯水有漂白性
两者都能使溴水褪色
B
用淀粉-KI鉴别FeCl2
Fe2+有氧化性
C
盐酸和氨水能溶解Al(OH)3
Al(OH)3是两性氢氧化物
D
CuSO4可以用作消毒剂
铜盐能使蛋白质变性
难度: 简单查看答案及解析
-
下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液:c(NH4HSO4) > c( (NH4)2SO4)> c(NH4Cl)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-) = c(HCO3-) + c(H2CO3) + c(CO32-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
难度: 中等查看答案及解析
-
在密闭容器中,对于可逆反应A+3B
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是

A.若正反应方向△H <0,则T1> T 2
B.压强增大时,混合气体的密度减小
C.A一定为气体
D.B一定为气体
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
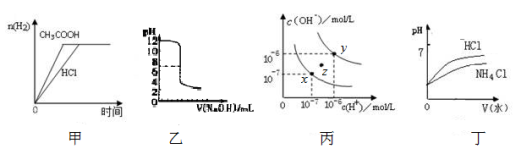
A.甲图曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中分别加人足量镁粉产生H2的物质的量的变化
B.乙表示将0.01mol·L-lNaOH溶液滴人到稀盐酸中的滴定曲线
C.丙为水的电离曲线,从z点刭x点,可采用在水中加入适量NaOH固体的方法
D.丁中曲线表示将pH相同的NH4C1溶液和盐酸稀释相同倍数时,二者pH的变化
难度: 中等查看答案及解析