-
下列两种气体的分子数一定相等的是( )
A.质量相等,密度不等的N2和C2H4
B.等密度、体积不等的CO2和C2H4
C.等温等体积的02和N2
D.等压等体积的N2和C02难度: 中等查看答案及解析
-
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变为蓝色.
下列判断正确的为( )
A.上述实验证明氧化性:MnO4->Cl2>Fe2+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性难度: 中等查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W难度: 中等查看答案及解析
-
实验室里需用480mL 0.1mol•L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68g硫酸铜,加入500mL水
B.称取12.0g胆矾配成500mL溶液
C.称取8.0g硫酸铜,加入500mL水
D.称取12.5g胆矾配成500mL溶液难度: 中等查看答案及解析
-
最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据.若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
A.是一种新的氧化物
B.不可能含有极性键
C.是氧元素的一种同位素
D.是臭氧的同分异构体难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.酸性氧化物都是非金属氧化物
B.所有物质中都存在化学键
C.含有极性键的分子一定是极性分子
D.含有离子键的化合物一定是离子化合物难度: 中等查看答案及解析
-
短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10.A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述正确的是( )
A.原子半径A<B<C
B.A的氢化物的稳定性大于C的氢化物
C.A的氧化物的熔点比C的氧化物高
D.A与C可形成离子化合物难度: 中等查看答案及解析
-
下列含有非极性键的共价化合物是( )
A.HCl
B.Na2O2
C.C2H2
D.CH4难度: 中等查看答案及解析
-
下列各项中表达正确的是( )
A.F-的结构示意图:
B.CO2的分子模型示意图: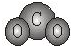
C.NaCl的电子式:
D.N2的结构式::N≡N:难度: 中等查看答案及解析
-
下列判断错误的是( )
A.熔点:Si3N4>NaCl>SiI4
B.沸点:NH3>PH3>AsH3
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:NaOH>Mg(OH)2>Al(OH)3难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.离子晶体中只存在离子键
B.原子晶体中只存在非极性共价键
C.冰是水分子间主要通过氢键作用有规则排列成的分子晶体
D.液态氯化钠和铜导线的导电原理是相同的难度: 中等查看答案及解析
-
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H3O+、NO3-、Fe2+、Na+
B.Ag+、NO3-、Cl-、K+、
C.K+、Ba2+、OH-、SO42-
D.Cu2+、NH4+、Br-、OH-难度: 中等查看答案及解析
-
下面关于SiO2晶体网状结构的叙述正确的是( )
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.最小的环上,有3个Si原子和3个O原子
C.最小的环上,Si和O原子数之比为1:2
D.最小的环上,有6个Si原子和6个O原子难度: 中等查看答案及解析
-
有关晶体的下列说法中正确的是( )
A.氯化钠熔化时离子键未被破坏
B.原子晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂
D.晶体中分子间作用力越大,分子越稳定难度: 中等查看答案及解析
-
下列离子方程式中,正确的是( )
A.向氯化亚铁溶液中通入氯气Fe2++Cl2═Fe3++2Cl-
B.三氯化铁溶液跟过量氨水反应Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+
C.碳酸氢钙溶液跟稀硝酸反应Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑
D.氯气通入冷的氢氧化钠溶液中2Cl2+2OH-═3Cl-+ClO-+H2O难度: 中等查看答案及解析
-
能用键能大小解释的是( )
A.N2的化学性质比O2稳定得多
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而磷酸难挥发难度: 中等查看答案及解析
-
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体.下列叙述错误的是( )
A.WX4是沼气的主要成分
B.固态X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”难度: 中等查看答案及解析
-
酸根离子RO3-所含电子数比硝酸根离子NO3-的电子数多10,则下列说法正确是( )
①R原子的电子层数比N原子的电子层数多1
②RO3-中R元素与NO3-中N元素的化合价相同
③RO3-和NO3-只能被还原,不可能被氧化
④R和N不是同周期元素,但是同主族元素.
A.①③④
B.①②④
C.①②
D.③④难度: 中等查看答案及解析
-
美国Lawtcce Lirermre国家实验室的V•Lota•C•S•Yoo和H•Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法正确是( )
A.CO2的原子晶体和分子晶体互为同素异形体
B.在一定条件下,CO2原子晶体转化为分子晶体是化学变化
C.CO2的原子晶体和CO2分子晶体具有相同的物理性质
D.CO2的原子晶体中,每个碳周围结合4个氧原子,每一个氧原子跟两个碳原子相结合难度: 中等查看答案及解析
-
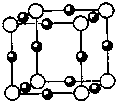
过渡元素的化合物是高温超导物质研究的热点.某过渡元素A与氧形成的化合物叫金红石,其晶体的最小结构单元如图.则下面有关金红石的说法正确的是( )
A.一定是共价化合物
B.可能是离子化合物
C.它的化学式为AO2
D.它的化学式为A3O2难度: 中等查看答案及解析
-
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.2.4g金属镁与足量的盐酸反应,转移电子数为2NA
B.9g重水含有的电子数为5NA
C.12g金刚石中含有碳碳键的个数为2NA
D.12.4g白磷中含有磷原子数为0.4NA难度: 中等查看答案及解析
-
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C
2AlN+3CO.下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体难度: 中等查看答案及解析
-
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则原混合溶液中钾离子物质的量浓度为( )
A.0.1(b-2a)mol/L
B.10(2a-b)mol/L
C.10(b-a)mol/L
D.10(b-2a)mol/L难度: 中等查看答案及解析