-
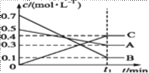
一定温度下在一个2 L的密闭容器中发生反应4A(s)+3B(g)
2C(g)+D(g),经2 min达平衡状态,此时B反应了1.2 mol。下列说法正确的是( )
A. 充入N2使压强增大可加快反应速率
B. A的平均反应速率为0.4 mol/(L·min)
C. 平衡状态时B、C的反应速率相等
D. C的平均反应速率为0.2 mol/(L·min)
难度: 中等查看答案及解析
-
在0.lmol•L-1醋酸溶液中存在:CH3COOH
CH3COO—+H+,对于该平衡,下列叙述正确的是 ( )
A. 加入少量NaOH固体,电离平衡向正向移动
B. 加入少量NaOH固体,溶液的pH减小
C. 加入少量CH3COONa固体,电离平衡向正向移动
D. 加入少量CH3COONa固体,CH3COO—浓度减小
难度: 中等查看答案及解析
-
关于小苏打水溶液的表达正确的是( )
A. c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C. HCO3-的电离程度大于HCO3-的水解程度
D. 存在的电离有:NaHCO3=Na++HCO3-,HCO3-
H++CO32-,H2O
H++OH-
难度: 中等查看答案及解析
-
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-==Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B. ②③ C. ②④ D. ③④
难度: 中等查看答案及解析
-
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-==ZnO+H2O;Ag2O+H2O+2e-==2Ag+2OH-
根据上述反应式,判断下列叙述中正确的是( )
A. 在使用过程中,电池负极区溶液的pH增大
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn是负极,Ag2O是正极
D. Zn电极发生还原反应,Ag2O电极发生氧化反应
难度: 中等查看答案及解析
-
有一化学平衡:mA(g)+nB(g)
pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )

A. 正反应吸热:m+n>p+q
B. 正反应吸热:m+n<p+q
C. 正反应放热:m+n>p+q
D. 正反应放热:m+n<p+q
难度: 中等查看答案及解析
-
在25 ℃、1.01×105 Pa下,反应2N2O5(g)4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1能自发进行的合理解释是( )
A. 该反应是分解反应
B. 该反应的熵增效应大于焓变效应
C. 该反应是熵减反应
D. 该反应是放热反应
难度: 简单查看答案及解析
-
下列各方程式中,属于水解反应的是 ( )
A.
+H2O
H2CO3+OH- B.
+H2O
+H3O+
C. HA+H2O
A-+H3O+ D.
+H+=
难度: 简单查看答案及解析
-
在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+ N(g)
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol•L-1.下列说法正确的是( )
A. 4min时,M的转化率为80%
B. 4min时,用M表示的反应速率为0.8mol•L-1•min-1
C. 4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D. 2min时,M的物质的量浓度为0.6mol•L-1
难度: 简单查看答案及解析
-
一定温度下,在2 L的密闭容器中发生反应:M(g)+2N(g)
xP(g) ΔH<0,N、P的物质的量随时间变化的关系如图所示。下列有关说法不正确的是( )
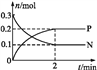
A. x=2
B. 反应开始2 min内,v(P)=0.1 mol·L-1·min-1
C. 2 min后,降低温度平衡向右移动
D. 当容器内混合气体压强不再改变时,反应体系达到化学平衡状态
难度: 中等查看答案及解析
-
物质的量浓度相等的下列溶液pH值由大到小的顺序是
A. Na2CO3、NaHCO3、NaCl、NH4Cl B. Na2CO3、NaHCO3、NH4Cl、NaCl、
C. Na2CO3、NaCl、NH4Cl、NaHCO3 D. Na2CO3、NH4Cl、NaHCO3、NaCl、难度: 中等查看答案及解析
-
能充分说明可逆反应N2(g)+O2(g)
2NO(g)已达到平衡状态的是( )
A. O2的消耗速率等于NO的消耗速率
B. 容器内始终有N2、O2和NO共存
C. 容器内反应混合物的总物质的量不随时间改变
D. V正(N2)=V逆(N2)
难度: 中等查看答案及解析
-
少量铁片与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L盐酸.
A. ①⑥⑦ B. ③⑤⑧ C. ③⑦⑧ D. ③④⑥⑦⑧
难度: 中等查看答案及解析
-
.在一定体积和一定条件下有反应N2(g)+3H2(g)
2NH3(g),现分别从两条途径建立平衡:
Ⅰ.起始浓度N2:1 mol·L-1,H2:3 mol·L-1
Ⅱ.起始浓度N2:2 mol·L-1,H2:6 mol·L-1
则下列叙述正确的是( )
A. Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B. 达到平衡时,途径Ⅰ的反应速率v(H2)等于途径Ⅱ的反应速率v(H2)
C. 达到平衡时,途径Ⅱ体系内混合气体的压强是途径Ⅰ内混合气体压强的2倍
D. 达到平衡时,途径Ⅰ体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的
难度: 中等查看答案及解析
-
下列操作中,能使电离平衡H2O
H++OH-,向右移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3固体
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使pH=6
难度: 中等查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是

A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
难度: 中等查看答案及解析
-
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)
CH3OCH3(g)+CO2(g) ,为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3mol CO、3mol H2)、体积(10L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是

A.X、Y两点对应的CO正反应速率相等
B.合成二甲醚的正反应△H>0
C.反应温度控制在240℃~260℃之间
D.选择合适催化剂,可以提高CO的转化率
难度: 中等查看答案及解析
-
下物质分类组合正确的是 ( )
A
B
C
D
强电解质
HCl
FeCl3
H3PO4
HClO
弱电解质
HF
CH3COOH
BaSO4
Ba(OH)2
非电解质
NH3
Cu
H2O
C2H5OH
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
中和c(H+)相同、体积相同的H2SO4 、HCl和CH3COOH溶液,耗用同一浓度的NaOH溶液, 体积分别为V1、V2 和V3 ,则V1、V2 和V3的关系正确的是( )
A. V1>V2=V3 B. V3>V2=V1 C. V1>V2>V3 D. V1=V2=V3
难度: 中等查看答案及解析
-
对于反应2SO2(g)+O2(g)
2SO3(g),能增大正反应速率的措施是( )
A. 通入大量O2 B. 增大容器容积
C. 移去部分SO2 D. 降低体系温度
难度: 中等查看答案及解析