-
下列有关能量转换的说法错误的是 ( )
A.酸碱中和反应放出的能量可设计为原电池转化为电能
B.煤燃烧是化学能转换为热能
C.太阳能热水器是利用太阳能转化为热能
D.可充电电池在充电时是电能转换为化学能,而放电时是化学能转化为电能
难度: 简单查看答案及解析
-
某同学为完成 2HCl+Fe=FeCl2+H2↑反应,设计了下列四个实验,如图所示,你认为不可行的是( )

难度: 简单查看答案及解析
-
以下自发反应可用焓判据来解释的是( )
A.硝酸铵自发溶于水
B.2N2O(g)===4NO2 (g) + O2(g) △H=+56.7kJ/mol
C.(NH4)2CO3(s)===NH4HCO3(s) + NH3(g) △H=+74.9kJ/mol
D.2H2(g) + O2(g)===2H2O(l) △H=-285.8kJ/mol
难度: 简单查看答案及解析
-
COCl2(g)
CO(g) + Cl2(g);△H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是 ( )
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A.铜锌原电池中铜是负极
B.用电解法精炼铜时粗铜作阴极
C.铅蓄电池放电时的负极在充电时作阴极
D.电解稀硫酸制H2、O2时可用铜作阳极
难度: 简单查看答案及解析
-
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g)
H2(g)+I2(g); △H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是 ( )

难度: 简单查看答案及解析
-
已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是 ( )
A. H2O(g) == H2(g)+1/2 O2(g); △H1=+242 kJ·mol-1
B.2 H2(g)+ O2(g)===2 H2O(l); △H2=- 484 kJ·mol-1
C.H2(g)+1/2 O2(g)====H2O(g) ; △H1=+242 kJ·mol-1
D.2 H2(g)+ O2(g)===2 H2O(g); △H2=+484 kJ·mol-1
难度: 简单查看答案及解析
-
一定温度下,对可逆反应 A(g)+ B(g)
2C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗amolA,同时生成2amolC
B.C生成的速率与C的分解速率相等
C.若容器体积不变,容器内的压强不再变化
D.混合气体的物质的量不再变化
难度: 简单查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-;DH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动, KW减小
B.向水中加入少量固体硫酸钠,平衡不移动,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体NH4Cl,平衡正向移动,c(H+)降低
难度: 简单查看答案及解析
-
以惰性电极电解500mL0.4mol/L的CuCl2溶液。若阳极上所产生气体的物质的量为0.25mol,则阴极上析出Cu的质量为( )
A. 16g B.32g C.19.2g D.12.8g
难度: 简单查看答案及解析
-
化学反应原理中涉及很多常数,下列说法错误的是( )
A.反应
的化学平衡常数表达式为
B.化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响
C.对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强
D.将AgNO3溶液和KCl溶液混合后,若c(Ag+)·c(Cl-)<KSP(AgCl),则溶液中无沉淀生成
难度: 简单查看答案及解析
-
下列说法与盐类水解无关的是( )
A.Na2CO3、NaHCO3被视作“碱”用于面食制作
B.NaHSO4溶液显酸性
C.铝盐可用作净水剂
D.TiCl4溶液经蒸干、焙烧制得TiO2
难度: 简单查看答案及解析
-
下面是用盐酸滴定氢氧化钠的实验叙述:①实验中的锥形瓶、滴定管都需润洗。②滴定前锥形瓶中有水将使滴定结果偏小。③加入2-3滴酚酞作指示剂。④滴定时,左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶,眼睛注视锥形瓶中颜色的变化。⑤滴定一旦发现溶液从红色变成无色,立即停止滴定。⑥滴定终了时溶液的pH值刚好为7。⑦若滴定前平视,滴定终点俯视,使结果偏小。上述相关说法中错误的是( )
A.①②④⑤ B.①②⑤⑦ C.①②⑤⑥ D.②⑤⑥⑦
难度: 简单查看答案及解析
-
一定条件下,在体积为10 L的恒容密闭容器中,发生如下反应:
2X(s)+Y(g)
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.用X 表示的化学反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若升高温度Y的转化率减小,则正反应为吸热反应
D.达到平衡时,Y与Z 的浓度相等
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热⊿H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3) kJ/mol
B.反应热是1mol物质参加反应时的能量变化
C.需要加热才能发生的反应不一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 简单查看答案及解析
-
从起始状态下A出发,在一定条件下可发生一系列变化,由图判断下列关系错误的是
A.A
D, △H=- △H4 B.△H1 + △H2 + △H3 + △H4 =0
C.A
C, △H=△H3 + △H4 D.∣△H2 + △H3∣=∣△H1 + △H4∣
难度: 简单查看答案及解析
-
将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g) + B(g) === 2C(g)反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol。则下列说法正确的是( )
A.该时间段C的化学反应速率为0.2mol/(L·s)
B.该时间段A的化学反应速率为0.125mol/(L·s)
C.该时间段B的化学反应速率为0.05mol/(L·s)
D.到4s末时,B的转化率为20%
难度: 简单查看答案及解析
-
常温下,把1mL0.1mol/L的H2SO4加水稀释到2L溶液,在此溶液中由水电离产生的H+浓度接近于 ( )
A.1.0×10-4mol/L B.1.0×10-8mol/L C.1.0×10-11mol/L D.1.0×10-10mol/L
难度: 简单查看答案及解析
-
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是 ( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极时,Cu2+向铜电极移动
难度: 简单查看答案及解析
-
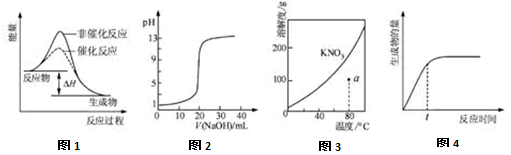
下列图示与对应的叙述相符的是( )
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的不饱和溶液
D.图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
难度: 简单查看答案及解析
