-
下列做法符合“绿色梦想,低碳行动”这一主题的是
①开发太阳能、风能和氢能等能源;②大量开采地下水,以满足生产、生活的需求;③在含硫的煤中加入适量生石灰;④利用苯、甲苯等有机物代替水作溶剂;⑤利用可降解的“玉米塑料”生产一次性饭盒。
A. ①③⑤ B. ①②③ C. ②④⑤ D. ①②④
难度: 简单查看答案及解析
-
下列各组物质,按化合物、单质、混合物顺序排列的是( )
A. 烧碱 液态氧 碘酒 B. 生石灰 白磷 熟石灰
C. 干冰 铁 氯化氢 D. 空气 氮气 胆矾
难度: 中等查看答案及解析
-
仅通过物理方法就能从海水中获得的物质是
A.钠、镁 B.溴、碘 C.食盐、淡水 D.氯气、烧碱
难度: 简单查看答案及解析
-
下列物质中,有共价键的是
A. 氦 B. 氯化镁 C. 溴化钾 D. 水
难度: 简单查看答案及解析
-
小明血液化验单中“甘三油醇”一项的结果为0.52×10-3 mol·L-1。这里的“0.52×10-3 mol·L-1”表示甘三油醇的
A. 物质的量 B. 摩尔质量 C. 质量分数 D. 物质的量浓度
难度: 简单查看答案及解析
-
下列关于葡萄糖和蔗糖的说法中,错误的是
A. 它们的分子式不同 B. 它们的分子结构不同
C. 它们不是同分异构体,但属同系物 D. 蔗糖可以水解生成葡萄糖和果糖
难度: 中等查看答案及解析
-
常温下,下列哪些物质可以保存在磨口玻璃瓶中
A. 氢氧化钠溶液 B. 氯水 C. 硅酸钠溶液 D. 氢氟酸
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. Na2O2的电子式为Na
Na
B. Cl-的结构示意图为
C. 硫酸氢钠溶液电离方程式:NaHSO4=Na++H+ +SO42-
D. 乙酸的结构式: C2H4O2
难度: 中等查看答案及解析
-
下列物质在一定条件下,可与CH4发生化学反应的是
①氯气 ②溴水 ③氧气 ④酸性KMnO4溶液
A. ①③ B. ②③ C. ②④ D. ①④
难度: 中等查看答案及解析
-
Se是人体必需微量元素,下列关于
Se和
Se的说法正确的是
A.
Se和
Se互为同位素 B.
Se和
Se都含有34个中子
C.
Se和
Se分别含有44和46个质子 D.
Se和
Se含有不同的电子数
难度: 中等查看答案及解析
-
在下列反应中,HCl作还原剂的是
A. NaOH+HCl===NaCl+H2O B. Zn+2HCl===ZnCl2+H2↑
C. MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑ D. CuO+2HCl===CuCl2+H2O
难度: 中等查看答案及解析
-
下列各组中的离子,能在溶液中大量共存的是
A. K+、H+、SO
、OH- B. Na+、Ca2+、CO
、NO
C. Na+、H+、Cl-、CO
D. Na+、Cu2+、Cl-、SO
难度: 简单查看答案及解析
-
下列有关物质用途的说法中,不正确的是
A. 漂白粉能漂白是因为Ca(ClO)2中的 ClO-有强氧化性
B. 明矾能够杀菌消毒是利用了胶体的吸附性
C. 氢氧化铝、碳酸镁、小苏打等可用于治疗胃酸过多
D. 二氧化硅可用于制造光导纤维
难度: 简单查看答案及解析
-
下图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是

A. 硝酸铵 B. 生石灰 C. 氯化镁 D. 食盐
难度: 简单查看答案及解析
-
下列离子的检验方法不合理的是
A. Cl-——加硝酸酸化的硝酸银溶液使其转变为沉淀
B. Fe3+——加硫氰化钾溶液使溶液颜色发生变化
C. SO42-——加酸使其转变为气体
D. NH4+——加碱使其转变为气体
难度: 中等查看答案及解析
-
下列离子方程式中,错误的是
A. 碳酸氢钠溶液与稀盐酸混合: CO32-+2H+===H2O+CO2↑
B. 氯气与KOH溶液反应:Cl2+2OH-===Cl-+ClO-+H2O
C. 将少量铜屑放入浓硝酸中:Cu+4H++2NO
===Cu2++2NO2↑+2H2O
D. 氯化铁溶液与铜反应:2Fe3++Cu===2Fe2++Cu2+
难度: 中等查看答案及解析
-
下列操作方法或实验装置正确的是
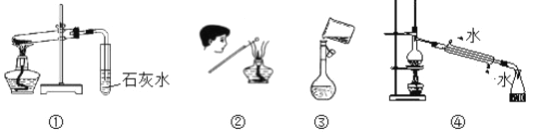
A. 装置① 探究NaHCO3的热稳定性 B. 检验K2CO3的K+
C. 装置③ 向容量瓶中转移液体 D. 装置④ 石油蒸馏
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 16 g O3中含有的原子数为NA
B. 标准状况下,22.4 L苯含有的碳原子数为6NA
C. 1 mol Cl2与足量的铁反应,转移的电子数为NA
D. 1 L 1 mol·L-1 MgCl2溶液中含有的氯离子数为NA
难度: 中等查看答案及解析
-
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是
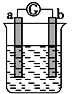
A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
难度: 中等查看答案及解析
-
对下列有机反应类型的认识中,错误的是
A.
取代反应
B. CH2=CH2+Cl2 →CH2 Cl CH2 Cl 加成反应
C. 2CH3CHO + O2
2CH3COOH 氧化反应
D. CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O 加成反应
难度: 中等查看答案及解析
-
CO和H2在一定条件下可以合成乙醇:2CO(g) +4H2(g)
CH3CH2OH(g) +H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是
A. CO全部转化为乙醇
B. 正反应和逆反应的化学反应速率均为零
C. CO和H2以1∶2的物质的量之比反应生成乙醇
D. 反应体系中乙醇的物质的量浓度不再变化
难度: 中等查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍。下列说法不正确的是
A. 原子半径Z>W>R
B. 对应的氢化物的热稳定性:R>W
C. W与X、W与Z形成的化学键类型完全相同
D. Y的最高价氧化物对应的水化物是弱酸
难度: 困难查看答案及解析
-
已知某亚铁盐的化学式可表示为(NH4)a Feb(SO4)c。取一定质量的该亚铁盐样品全部溶于足量的水中,将所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀9.32 g。另一份溶液同足量的浓NaOH溶液共热,产生的氨气用100 mL 0.5mo1·L-1稀硫酸吸收后(设产生的氨全部逸出),剩余的硫酸再用1.5 mol·L-1NaOH溶液中和,需NaOH溶液40mL。该亚铁盐样品中b:c的比值为
A. 1:1 B. 2:1 C. 1:2 D. 3:2
难度: 中等查看答案及解析