-
下列对化学反应的认识,错误的是( )
A.会引起化学键的变化
B.会产生新物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化难度: 中等查看答案及解析
-
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
关于原子轨道的说法正确的是( )
A.凡是中心原子采取sp3杂化方式成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化方式成键难度: 中等查看答案及解析
-
下列说法正确的是( )
A.用酸性KMnO4溶液鉴别乙烯和乙炔
B.将铁屑、溴水、苯混合可制得溴苯
C.调查发现有些装饰程度较高的居室中,由装饰材料缓慢释放出来的化学污染物浓度过高,影响健康,这些污染物主要是甲酸和SO2等气体
D.将铜丝在酒精灯火焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色难度: 中等查看答案及解析
-
下列有关概念或原理的叙述正确的是( )
A.氨基酸、蛋白质和氧化铝一样既能与酸反应,又能与碱反应所以他们都是两性氧化物
B.制造婴儿用的一次性纸尿片采用的吸水保水的材料可以是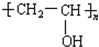
C.乙烯和聚乙烯都能使KMnO4(H+)溶液褪色
D.甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是他们既可以发生水解反应,又可以发生银镜反应难度: 中等查看答案及解析
-
我国已成功发射了“神舟”九号,其中一名航天员身穿国产的舱外航天服首次实现了太空行走.该航天服的面料是由高级混合纤维制造而成的,据此分析,该面料一定不具有的性质是( )
A.强度高,耐高温
B.防辐射,防紫外线
C.能抗骤冷、骤热
D.有良好的导热性,熔点低难度: 中等查看答案及解析
-
能与NaOH溶液、新制Cu(OH)2悬浊液、纯碱溶液、溴水、苯酚钠、甲醇都起反应的是( )
A.CH3COOH
B.CH2═CHCOOH
C.盐酸
D.乙酸甲酯难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.聚丙烯的结构简式:
B.丙烷分子的比例模型:
C.四氯化碳分子的电子式:
D.2-乙基-1,3-丁二烯分子的键线式:难度: 中等查看答案及解析
-
两种不同的烃CxHy和CaHb不论以什么比例混合,只要总质量一定,完全燃烧时消耗O2的质量和生成水的质量不变,下列叙述正确的是( )
A.CxHy和CaHb分子中氢原子数一定相等
B.可能是C2H4和C3H6的混合物
C.CxHy和CaHb一定是同分异构体
D.CxHy和CaHb的最简式可以不同难度: 中等查看答案及解析
-
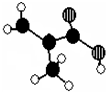
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
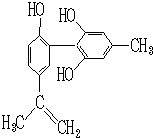
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4(H+)溶液,观察紫色褪去,说明结构中有可能存在不饱和碳碳键
C.1 mol该物质分别与浓溴水、H2反应时最多消耗Br2和H2分别为6 mol、7 mol
D.该分子中的所有原子有可能共平面难度: 中等查看答案及解析
-
已知X、Y是主族元素,In为逐级电离能,单位是kJ•mol-1.请根据下表所列数据判断,错误的是( )
元素 I1 I2 I3 I4 X 500 4600 6900 9500 Y 580 1800 2700 11600 Z 7800 10589
A.元素X的常见化合价是+1,元素Y是ⅢA族元素
B.元素Z可能为稀有气体元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应难度: 中等查看答案及解析
-
根据键能数据估算CH4(g)+4F2(g)═CF4+4HF(g)的反应热△H为( )
化学键 C-H C-F H-F F-F 键能/(kJ/mol) 414 489 565 155
A.-1940 kJ/mol
B.+1940 kJ/mol
C.-485 kJ/mol
D.+485 kJ/mol难度: 中等查看答案及解析
-
有4种有机物:
①②
③
④CH3-CH=CH-CN
其中可用于合成结构简式为 的高分子材料的正确组合为( )
的高分子材料的正确组合为( )
A.①③④
B.①②③
C.①②④
D.②③④难度: 中等查看答案及解析
-
某有机物A,它的氧化产物甲和还原产物乙都能和金属钠反应放出H2.甲和乙反应可生成丙,甲和丙均能发生银镜反应.有机物A是( )
A.甲醇
B.甲醛
C.甲酸
D.甲酸甲酯难度: 中等查看答案及解析
-
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形难度: 中等查看答案及解析
-
在乙烯分子中有5个σ键、一个π键,它们分别是( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键难度: 中等查看答案及解析
-
对充有氖气的霓红灯管通电,灯管发出红色光.产生这一现象的主要原因( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流作用下,氖原子与构成灯管的物质反应难度: 中等查看答案及解析
-
下列说法中错误的是( )
A.根据对角线规则,铍和铝的性质具有相似性
B.在H3O+、NH4+ 和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.P4和CH4都是正四面体分子且键角都为109°28′难度: 中等查看答案及解析
-
已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论错误的是( )
A.氯化铝是电解质
B.固体氯化铝是分子晶体
C.可用电解熔融氯化铝的办法制取金属铝
D.氯化铝为非极性分子难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.金属的熔点和沸点都很高
B.H2O2、PCl5都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的酸性依次增强
D.H2O是一种非常稳定的化合物,这是由于氢键所致难度: 中等查看答案及解析
-
在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2⇌2SO3,下列叙述能够说明反应已经达到平衡状态的是( )
A.容器中SO2、O2、SO3共存
B.SO2与SO3的浓度相等
C.容器中SO2、O2、SO3的物质的量之比为2:1:2
D.SO2与SO3的浓度不再变化难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.1mol甲基(-CH3)所含的电子总数为10NA
D.现有乙烯.丙烯(C3H6).丁烯(C4H8)的混合气体共14g,其原子数为3NA难度: 中等查看答案及解析
-
能与Na反应放出H2,又能使溴水褪色,但不能使pH试纸变色的物质是( )
A.CH2=CH-COOH
B.CH2=CH-CH2OH
C.CH3CH2OH
D.CH2=CH-COOCH3难度: 中等查看答案及解析
-
ZnS晶体结构有两种型式,即立方ZnS和六方ZnS,如图所示,这两种型式的ZnS,化学键的性质相同,都是离子键向共价键过渡,具有一定的方向性.下列说法错误的是( )

A.Zn原子和S原子的配位数都是4,不同的是原子堆积方式有差别
B.在立方ZnS中,S原子作立方最密堆积,在六方ZnS晶体中,S原子作六方最密堆积
C.在立方ZnS中,Zn原子填充在所有的四面体空隙中,形成立方面心点阵
D.立方ZnS和六方ZnS不属于同分异构体难度: 中等查看答案及解析