-
碳是构成地球生命的重要元素。下列说法正确的是
A. 自然界中不存在游离态的碳
B. 碳的化合物数量众多,分布极广
C. 向空气中排放二氧化碳会形成酸雨
D. 煤、石油、天然气属于可再生碳资源
难度: 中等查看答案及解析
-
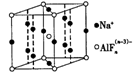
下列有关化学用语表示正确的是
A. 中子数为8的氮原子
B. 钠原子的结构示意图:
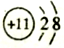
C. 氧化钠的电子式:
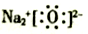 D. 2-戊烯的结构简式:CH3CH2CH=CHCH3
D. 2-戊烯的结构简式:CH3CH2CH=CHCH3难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 液氨气化吸热,可用作制冷剂 B. 明矾易溶于水,可用作净水剂
C. 盐酸具有还原性,可用于除去铁锈 D. 浓硝酸具有酸性,可用于钝化铁、铝
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层电子数是次外层的2倍,Y是非金属性最强的元素,在周期表中Z位于IIA,Y与W属于同一主族。下列说法正确的是
A. 简单气态氢化物的热稳定性:Y<W
B. 原子半径:r(X)<r(Y)<r(Z)<r(W)
C. Z和W的简单离子具有相同的电子层结构
D. 化合物ZX2中既含有离子键,又含有共价键
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 投入足量漂白粉后的溶液中:Fe2+、H+、Cl-、SO42-
B. 0.1mol/LFeCl3溶液中:Na+、Ba2+、NO3-、SCN-
C.
的溶液中:NH4+、Ca2+、Cl-、NO3-
D. 水电离的c(OH-)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32-
难度: 困难查看答案及解析
-
为制取含HClO浓度较高的溶液,下列图示装置和原理均正确,且能达到实验目的的是

A. 制取氯气 B. 制取氯水 C. 提高HClO浓度 D. 过滤
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 向碳酸钠溶液中加入过量醋酸:CO32-+2H+=H2O+CO2↑
B. 向偏铝酸钠溶掖中通入过量二氧化碳;CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-
C. 向莫尔盐[(NH4)2Fe(SO4)2·6H2O]溶液中加入过量氧氧化钠溶液:NH4++Fe2++3OH-=NH3·H2O+Fe(OH)2↓
D. 向双氧水中加入酸性高锰酸钾溶液:5H2O2+2MnO4-=2Mn2++5O2↑+6OH-+2H2O
难度: 困难查看答案及解析
-
H2是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是
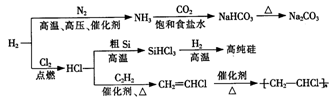
A. 使用催化剂可以降低合成氨反应的活化能
B. 用澄清石灰水可以检脸NaHCO3中是否混有Na2CO3
C. 由粗硅制高纯硅的反应类型依次为化合反应、置换反应
D. 聚合物
的链节为CH2=CHCl
难度: 困难查看答案及解析
-
下列说法正确的是
A. 反应2H2(g)+O2(g)=2H2O(l) 在室温下可自发进行,则该反应的△H<0
B. 常温常压下,7.8gNa2O2与水完全反应,产生1.12L气体
C. 煤的干馏是物理变化,石油的裂化是化学变化
D. 气体分子总数不再改变时,反应H2(g)+I2(g)
2HI(g))达到平衡
难度: 困难查看答案及解析
-
下列图示与对应的叙述符合的是
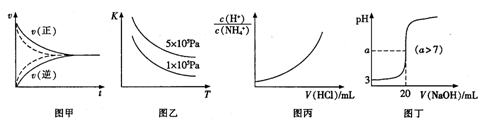
A. 用甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B. 图乙表示反应2SO2(g)+O2(g)
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C. 图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中
随HCl溶液体积变化关系
D. 图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
难度: 困难查看答案及解析
-
化合物X是一种医药中间体,其结构简式如图所示。下列有关X的说法正确的是
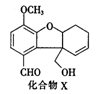
A. 分子中含2个手性碳原子
B. 分子中所有碳原子均处于同一平面
C. 能发生银镜反应,不能发生酯化反应
D. 1molX最多能与4molH2发生加成反应
难度: 中等查看答案及解析
-
一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液。电池中发生的反应为2VCl2+BrCl2-
2VCl3+Br-。

下列说法正确的是
A. VCl2存储在正极储液罐内
B. 放电时H+从负极区移至正极区
C. 充电时电池的负极与电源的正极相连
D. 充电时阳极反应为Br-+2Cl--2e-=BrCl2-
难度: 困难查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作
结论
A
相同条件下,分别测量0.1mol/L和0.01mol/L的醋酸溶液的导电性,前者的导电性强
醋酸浓度越大,电离程度越大
B
向Co2O3固体中滴加浓盐酸,有黄绿色气体生成
氧化性:Co2O3>Cl2
C
向淀粉溶液中滴加少量稀硫酸,水浴加热一段时间后冷却,向溶液中滴加碘水,溶液变蓝
淀粉未发生水解
D
常温下,分别测量浓度均为0.1mol/L的Na2S溶液和NaClO溶液的pH,前者的pH大
酸性:HClO>H2S
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是
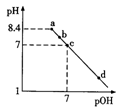
A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)
难度: 困难查看答案及解析
-
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
PCl5(g)=====PCl3(g)+Cl2(g) △H=akJ/mol(a>0)
0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法正确的是
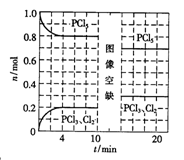
A. 0~4min的平均速率v(Cl2)=0.05mol/(L·min )
B. 10min时改变的条件是分离出一定量的PCl5
C. 起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,反应达平衡时放出的热量大于1.6akJ
D. 温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反应达到平衡前,v(正)>v(逆)
难度: 困难查看答案及解析


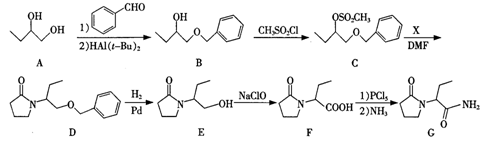
 和
和 ,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。
,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。 )随温度的变化如右图所示。
)随温度的变化如右图所示。

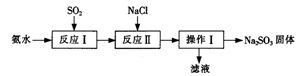
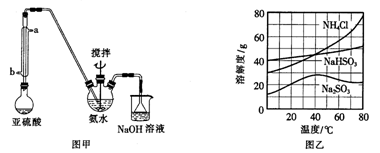
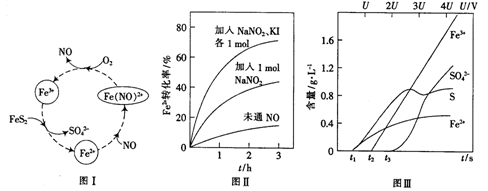
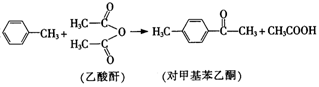 的催化剂。
的催化剂。