-
下列物质属于弱电解质的是
A. 氨水 B. 盐酸 C. 碳酸 D. 硫酸钡
难度: 简单查看答案及解析
-
下列属于放热反应的是
A. 碳酸钙高温分解 B. 铝热反应
C. 氢气还原氧化铜 D. 氢氧化钡晶体和氯化铵晶体混合搅拌
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好呈中性Ba2++OH-+H++SO42-=BaSO4↓+2H2O
B. NH4HCO3溶液中加入过量NaOH稀溶液: NH4+ + OH- = NH3 + H2O
C. 向醋酸溶液中通入氨气: H+ + OH- = H2O
D. 碳酸钙溶于稀硝酸: CaCO3 + 2H+ = Ca2+ + CO2 + H2O
难度: 简单查看答案及解析
-
下列描述正确的是
A. 在25℃、101KPa时,盐酸和NaOH稀溶液的中和热 ΔH=-57.3kJ/mol,则H2SO4和Ba(OH)2的反应的反应热 ΔH=2×(-57.3)kJ/mol
B. 在25℃、101KPa时, CO(g)的燃烧热为283.0KJ/mol,则相同条件下2CO2(g)= 2CO(g)+O2(g)反应的ΔH= +(2×283.0)kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 在25℃、101KPa时,1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 简单查看答案及解析
-
下列关于“中和反应反应热的测定”实验描述正确的是
A. 为了反应充分进行,应使用50mL0.5mol/L的盐酸和50mL0.55mol/L的NaOH溶液反应
B. 为了操作安全,可将NaOH溶液分多次倒入50mL0.5mol/L的盐酸中进行反应
C. 用量筒量取50.0mL盐酸时,俯视刻度会导致所取盐酸的体积偏大
D. 实验过程中,使用环形铜棒搅拌,使溶液充分混合
难度: 简单查看答案及解析
-
下列说法正确的是
A. 凡是吸热反应都是非自发的
B. 所有的反应都需要活化能的推动才能发生
C. 焓变和熵变是判断反应方向的两个主要因素
D. 自发反应在任何条件下都能实现
难度: 简单查看答案及解析
-
在反应2A(g) + B(g)
3C(s) + 4D(g) 中,下列关系正确的是
A. 2ν(A)=ν(B) B. 3ν(B)=ν(C)
C. 4ν(C)=3ν(D) D. 2ν(A)=ν(D)
难度: 简单查看答案及解析
-
反应A(g) + 3B(g)
2C(g) + 2D(g) 在四种情况下的反应速率分别为①ν(A)=0.25mol/(L·s) ②ν(B)=27mol/(L·min) ③ν(C)=0.4mol/(L·s) ④ν(D)=36mol/(L·min)。下列选项正确的是
A. ④>①>③>② B. ③<②<④<①
C. ①>②>③>④ D. ④>②>③>①
难度: 简单查看答案及解析
-
10mL浓度为1mol/L的盐酸和过量的锌反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A. 再加入10mL浓度为0.5mol/L的硫酸
B. 加入几滴CuCl2溶液
C. 加入几滴NaNO3溶液
D. 加入少量CH3COONa溶液
难度: 简单查看答案及解析
-
一定温度下,恒容密闭容器中进行的可逆反应H2(g) + I2(g)
2HI(g),达到平衡状态的标志是
A. 单位时间内消耗a mol H2,同时生成2a mol HI
B. 混合气体的平均摩尔质量不再变化
C. H2、I2、HI的物质的量之比为1:1:2
D. 混合气体的颜色不再变化
难度: 中等查看答案及解析
-
在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
难度: 中等查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是
A. 2HI
H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
B. 氯水中存在下列平衡:Cl2 + H2
HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
C. 在合成氨的工业生产中要及时将生成的氨气分离出去
D. 可用浓氨水和氢氧化钠固体快速制取氨气
难度: 简单查看答案及解析
-
某密闭体系中发生反应:N2(g) + 3H2(g)
2NH3(g)ΔH< 0,右图是某一时间段中反应速率(ν)与反应时间(t)的曲线关系图,图t1时刻改变的条件是
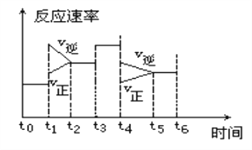
A. 增大压强 B. 升高温度
C. 降低温度 D. 减小压强
难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的事
A. 纯碱溶液去油污
B. 明矾可以净水
C. 加热氯化铁溶液颜色加深
D. 铁在潮湿的环境下生锈
难度: 中等查看答案及解析
-
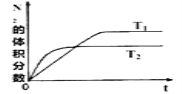
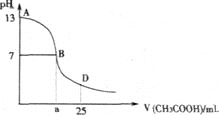
下列图示与对应的叙述相符的是
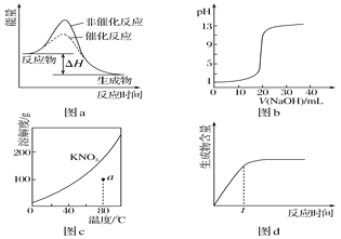
A. 图a表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图b表示0.100 0mol·L-1NaOH溶液滴定20.00mL 0.100 0mol·L-1CH3COOH溶液所得到的滴定曲线
C. 图c表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D. 图d表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时刻反应物转化率最大
难度: 中等查看答案及解析
-
在下列实验方法中,不能证明醋酸是弱酸的是( )
A. 25 ℃时,醋酸钠溶液呈碱性
B. 25 ℃时,0.1 mol/L的醋酸的pH约为3
C. 25 ℃时,等体积的盐酸和醋酸,前者比后者的导电能力强
D. 25 ℃时,将pH=3的盐酸和醋酸稀释成pH=4的溶液,醋酸所需加入的水多
难度: 中等查看答案及解析
-
25℃时,用少量蒸馏水稀释0.10mol·L-1的醋酸,若用Kw表示水的离子积常数,则下列各式表示的数值随水量的增加而增大的是
A. c(CH3COO-)/c(CH3COOH)
B. c(CH3COOH)/c(H+)
C. c(H+)/Kw
D. c(H+)/c(OH-)
难度: 中等查看答案及解析
-
关于①100mL0.01mol·L-1Na2CO3②10mL 0.1mol·L-1Na2CO3两种溶液的叙述正确的是
A. 溶液中水电离出的H+个数:② > ①
B. 溶液中阴离子的总物质的量浓度之和① > ②
C. ①溶液中:n(OH-)-n(H+)=n(HCO3-)+ 2n(H2CO3)
D. ②溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
难度: 困难查看答案及解析
-
在下列溶液中,离子一定能大量共存的是
A. 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
B. 含有0.1mol•L-1FeCl3的溶液中:K+、Mg2+、I-、NO3-
C. 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3-
D. 水电离出的c(H+)=1×10-10 mol·L-1溶液中:K+、Na+、AlO2-、SO42-
难度: 中等查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HClO
H2CO3
H2SO3
电离平衡常数
(25℃)
Ka=1.77×10-4
Ka=4.0×10-8
Ka1=4.3×10-7
Ka2=4.7×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
下列选项正确的是
A. 2ClO- + H2O + CO2 = 2HClO + CO32-
B. 2HCOOH + CO32- = 2HCOO- + H2O + CO2↑
C. H2SO3 + 2ClO- = 2HClO + SO32-
D. SO2(足量) + H2O+ CO32- = 2H2O + CO2+ SO32-
难度: 困难查看答案及解析
-
下列说法不正确的是
A. pH=3的某溶液加水稀释到pH=5,水的电离程度不一定增大
B. 相同pH的CH3COONa, NaOH和Na2CO3三种溶液:c(CH3COONa)>c(Na2CO3)>c(NaOH)
C. 0.10mol·L-1NaHA溶液的pH=5,则溶液中:c(HA-)>c(H+)>c(A2-)>c(H2A)
D. 0.10mol·L-1 pH=7.8 NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
下列说法正确的是
A. 氯碱工业中可以使用阴离子交换膜
B. 电解法精炼铜时,电路中每转移2mol电子,阳极质量就减少64g
C. 镀锌铁镀层破坏后锌仍能减缓铁腐蚀,其原理为牺牲阳极的阴极保护法
D. 第五套人民币的一元硬币材质为铜芯镀银,在电镀过程中,铜芯应做阳极
难度: 中等查看答案及解析
-
为倡导“低碳”理念,可以大力发展燃料电池并加以推广。现在常见的燃料电池有4种,下面是这4种燃料电池的工作原理示意图,其中正极反应产物为水的是
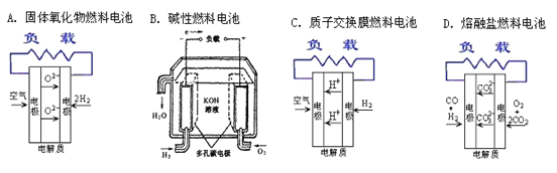
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用氟硼酸(HBF4,属于强酸)代替硫酸做铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,正极区pH增大
B. 充电时,Pb电极与电源的正极相连
C. 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
D. 充电时,当阳极质量增加23.9g时,溶液中有0.2 mole-通过
难度: 中等查看答案及解析
-
已知:Ksp(ZnS)=2.0×10−22,Ksp(CuS)=1.3×10−36,向等物质的量浓度ZnSO4和CuSO4的混合溶液中,逐滴加入1.5 mol·L−1的Na2S溶液直至溶液中无沉淀产生,然后过滤。下列说法不正确的是
A. 先生成CuS后生成ZnS沉淀,属于沉淀的转化
B. 当ZnS沉淀完全时,溶液中
=6.5×10−15
C. 过滤得到的沉淀是CuS和ZnS的混合物
D. 过滤后得到的溶液中仍有极少量的Cu2+和Zn2+
难度: 中等查看答案及解析