-
已知Ca(OH)2的溶解度随温度升高而降低.将40℃的饱和澄清石灰水冷却至10℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是( )
A.溶液中Ca2+的数目
B.溶剂的质量
C.溶液中溶质的物质的量浓度
D.溶质的质量难度: 中等查看答案及解析
-
下列相关实验不能达到预期目的是( )
相关实验 预期目的 ① 相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓度的盐酸反应 探究接触面积对化学反应速率的影响 ② 把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 探究温度对化学平衡的影响 ③ 在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜并加热 探究蔗糖水解产物具有还原性 ④ 两支试管中装有等体积、等浓度H2O2溶液,向其中一支试管中加入FeCl3溶液 探究FeCl3溶液对H2O2分解速率的影响
A.①
B.②
C.③
D.④难度: 中等查看答案及解析
-
仅通过物理方法就能从海水中获得的物质是( )
A.钠、镁
B.溴、碘
C.食盐、淡水
D.氯气、烧碱难度: 中等查看答案及解析
-
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体难度: 中等查看答案及解析
-
化学与生活密切相关,下列有关说法正确的是( )
A.维生素C具有还原性,在人体内起抗氧化作用
B.糖类、蛋白质、油脂都属于天然高分子化合物
C.煤经气化和液化两个物理变化过程,可变为清洁能源
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料难度: 中等查看答案及解析
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素的单质,不可能既能与酸反应,又能与碱反应
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.乙醛的结构简式:CH3COH
B.S2-的结构示意图:
C.葡萄糖的实验式:CH2O
D.HCl的电子式:难度: 中等查看答案及解析
-
常温下,将某盐酸与氢氧化钠溶液混合后,向其中滴加紫色石蕊试液,溶液变红,下列说法不正确的是( )
A.混合后溶液的pH<7
B.混合后溶液为氯化钠溶液
C.混合后溶液的质量是混合前两种溶液的质量之和
D.混合后溶液中水的质量大于混合前两种溶液中水的质量之和难度: 中等查看答案及解析
-
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )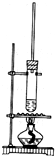
A.不能用水浴加热
B.长玻璃管有冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率难度: 中等查看答案及解析
-
下列离子反应,表达正确的是( )
A.CaCO3与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑
C.碳酸钠水【解析】
CO32-+2H2OH2CO3+2OH-
D.硫酸铝溶液与过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+难度: 中等查看答案及解析
-
有关实验的叙述,正确的是( )
A.将称好的NaOH加入容量瓶中溶解,并稀释至刻度,配成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上,测定该溶液pH
C.欲制备Fe(OH)3胶体,向盛有25ml沸水的烧杯中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸,至溶液呈红褐色
D.氨气能使湿润的蓝色石蕊试纸变红难度: 中等查看答案及解析
-
下列关于等物质的量浓度、等体积的盐酸和醋酸溶液说法正确的是( )
A.在相同条件下,导电能力相同
B.分别稀释到等pH时,得到稀溶液的体积相同
C.分别与足量锌反应时,相同状况下产生的V(H2)不同
D.分别与氢氧化钠溶液反应得到中性溶液时,消耗的n(NaOH)不同难度: 中等查看答案及解析
-
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
2PbSO4+2H2O则下列说法正确的是( )
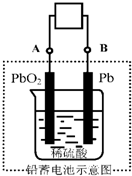
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb-2e-+SO42-PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+难度: 中等查看答案及解析
-
室温下,水的电离达到平衡:H2O═H++OH-.下列叙述正确的是( )
A.将水加热,平衡向正反应方向移动,Kw不变
B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)=c(H+)难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.酒精和硝酸银溶液均能使蛋白质变性
B.乙烯和二氧化硫均能使酸性KMnO4溶液褪色
C.水晶项链、光导纤维、玻璃、瓷器等都是硅酸盐制品
D.反应AgBr+KI=AgI+KBr能在水溶液中进行,是因为AgI比AgBr更难溶于水难度: 中等查看答案及解析
-
下图有关电化学的示意图正确的是( )
A.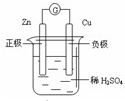
B.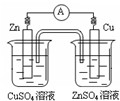
C.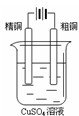
D.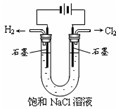
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.2.24LCO2中含有的原子数为0.3×6.02×1023
B.1.8gNH4+含有的质子数为6.02×1023
C.30g乙酸和甲酸甲酯的混合物中含有的共价键数为4×6.02×1023
D.7.8gNa2O2中含有的阴离子数为0.2×6.02×1023难度: 中等查看答案及解析
-
短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期.X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1.下列比较正确的是( )
A.元素非金属性:Z>Y>X
B.最高价氧化物水化物酸性:Z>Y
C.原子半径:Z<Y<X
D.气态氢化物的稳定性:Z<Y<X难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++OHNH3↑+H2O
C.稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=2H2O+I2难度: 中等查看答案及解析
-
M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下.下列叙述不正确的是( )
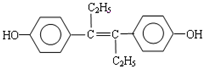
A.M的分子式为C18H20O2
B.M可与NaOH溶液或NaHCO3溶液均能反应
C.1molM最多能与7molH2发生加成反应
D.1molM与饱和溴水混合,最多消耗5molBr2难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的是( )
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ)
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低难度: 中等查看答案及解析
-
锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲 33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1,下列叙述不正确的是( )
A.反应中共消耗1.8molH2SO4
B.气体甲中SO2与H2的体积比为4:1
C.反应中共消耗97.5gZn
D.反应中共转移3mol电子难度: 中等查看答案及解析
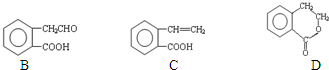
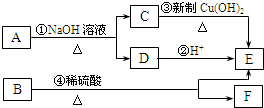
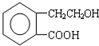 它可通过不同化学反应分别制得B、C和D 三种物质.
它可通过不同化学反应分别制得B、C和D 三种物质.