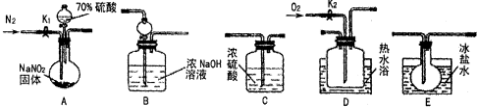-
下列装置、试剂选用或操作正确的是( )

A.除去NO中的NO2 B.用于AlCl3蒸发结晶 C.稀释浓硫酸 D.制备少量O2
难度: 中等查看答案及解析
-
下列选项中有关离子方程式的书写正确的是( )
A.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O=HCO3-+HClO
D.硫化钠水溶液呈碱性的原因:S2-+2H2O=H2S+2OH-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列各项叙述正确的是( )
①1 molCl2参加反应转移电子数一定为2NA
②1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
③标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA
④1L 2mol·L-1的Al(NO3)3溶液中含Al3+个数为2NA
⑤1 L 2 mol/L的氯化铁溶液完全制成胶体,氢氧化铁胶体的粒子数小于2 NA
⑥6.0 g SiO2晶体中含有的硅氧键数目为0.4 NA
⑦1 molCH3+ 所含的电子数为8NA
⑧在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA
⑨300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
⑩标准状况下,2.24 L乙醇分子所含的C-H键数为 0.5NA
A. ②③⑦⑧⑨⑩ B.①②③⑤⑧⑨ C.②⑤⑥⑦⑧ D.②④⑦⑧⑩
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
①0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-、NO3-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、S2-
A.①③⑤ B.② C.②④⑥ D.④⑤
难度: 困难查看答案及解析
-
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+
O2(g) = SO2(g)+H2O(g) △H 1
②2H2S(g)+SO2(g) =
S2(g)+2H2O(g) △H 2
③H2S(g)+
O2(g) = S(g)+H2O(g) △H 3
④S(g) =
S2(g) △H4
则△H 4的正确表达式为 ( )
A.△H 4 =
(3△H 3 - △H 1 - △H 2)
B. △H 4 =
(△H 1 + △H 2 - 3△H 3)
C.△H 4 =
(△H 1 + △H 2 - 3△H 3)
D.△H 4 =
(△H 1 - △H 2 - 3△H 3)
难度: 困难查看答案及解析
-
某温度下,恒容密闭容器中发生如下可逆反应:2 E(g)
F(g) + x G(g)(正反应放热);若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5amol/L,若E的起始浓度改为2amol/L,F、G 浓度仍为0,当达到新的平衡时,下列说法正确的是( )
A.升高温度时,正反应速率加快,逆反应速率减慢,平衡逆向移动
B.若x=1,新平衡下E转化率为50%
C.若x=2,新平衡下F的平衡浓度为0.5a mol/L
D.若x=2,换成恒压容器,则达到平衡所需时间比恒容容器所需时间短
难度: 简单查看答案及解析
-
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )

A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.图中C点对应溶液体积为48mL
C.原硝酸溶液中含硝酸的物质的量为0.5mol
D.样品中铝粉和铁粉的物质的量之比5:3
难度: 困难查看答案及解析