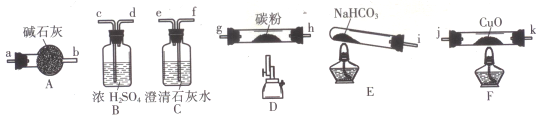
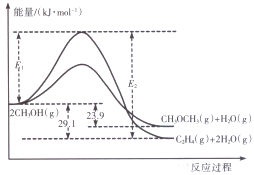
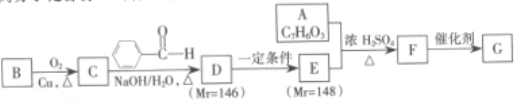
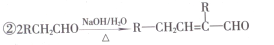-
下列离子方程式不正确的是
A.纯碱溶液中滴加酚酞溶液显红色:CO32 -+H2O
HCO3- +OH-
B.烧碱溶液与小苏打溶液混合:OH-+HCO3- =H2O+CO32 -
C.硫代硫酸钠溶液与稀硫酸混合:3S2O32 -+6H+=4S↓+3H2O+2SO3
D.氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
难度: 困难查看答案及解析
-
下列说法正确的是
A.乙烯使溴水或酸性高猛酸钾溶液褪色均属于加成反应
B.乙醇与浓硫酸混合,加热至170 ℃制乙烯的反应属于取代反应
C.用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应
D.等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同
难度: 困难查看答案及解析
-
下列实验所用试剂、现象和结论均正确的是
实验序号
实验内容
试剂
现象和结论
①
鉴别K2CO3和Na2SO3
盐酸、澄清的石灰水
产生无色无味气体,能使澄清的石灰水变浑浊的是K2CO3
②
鉴别NO2 和Br2蒸气
湿润的淀粉KI试纸
试纸变蓝色的是Br2
③
鉴别葡萄糖和蔗糖
银氨溶液
有银镜产生的是葡萄糖
④
鉴别AlCl3 溶液和MgCl2溶液
氨水
产生白色沉淀然后消失的是AlCl3 溶液
A.①③ B.①② C.②④ D.②③
难度: 困难查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A.
与
氧化能力相近,二者互为同位素
B.
与
所含质子数相同,中子数不同
C.同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱
D.同周期主族元素形成的简单离子半径随核电荷数的增大而减小
难度: 中等查看答案及解析
-
某小组用下图装置进行实验,下列说法正确的是

A.盐桥中的电解质可以用KC1
B.闭合K,外电路电流方向为Fe电极→石墨电极
C.闭合K,石墨电极上只生成铜
D.导线中流过0.15 mol
时,加入5.55 gCu2(OH)2CO3 ,CuSO4溶液可恢复原组成
难度: 困难查看答案及解析
-
25 ℃时,关于①O.l mol·L-1的NH4Cl溶液②0.1 mol·L-1的NaOH溶液,下列叙述正确的是
A.若向①中加适量水,溶液中c(Cl-)/c(NH4+ )的值减小
B.若向②中加适量水,水的电离平衡正向移动
C.若将①和②均稀释100倍,①的pH变化更大
D.若将①和②混合,所得溶液的pH=7,则溶液中的c(NH3·H2O)>c(Na+)
难度: 困难查看答案及解析
-
某稀溶液中含有4 mol KNO3和2.5 mol H2SO4 ,向其中加入1.5 mol Fe,充分反应(已知NO3- 被还原为NO)。下列说法正确的是
A.反应后生成NO的体积为28 L
B.所得溶液中的溶质只有FeSO4
C.所得溶液中c(NO3- )=2.75 mol·L-1
D.所得溶液中c(Fe2+):c(Fe3+ )=1:1
难度: 困难查看答案及解析