-
化学与生活密切相关,下列说法不正确的是( )
A.风能、生物质能、沼气是可再生能源,煤、石油、天然气是不可再生能源
B.“84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感
C.雾霾天气严重影响人类健康,PM2.5是指大气中直径小于或者等于2.5微米的颗粒物,也称为“细颗粒物”PM2.5在空气中可能形成胶体。
D.已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术,可以降低自然界中碳的含量
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.CaH2的电子式:[H:]_Ca2+[:H]- B.铝离子的结构示意图:
C.CO2的比例模型:
D.核内有8个中子的碳原子:
难度: 中等查看答案及解析
-
下列变化过程,属于放热反应的是 ( )
①生石灰与水反应;②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌;③醋酸电离;④固体氢氧化钠溶于水;⑤H2在Cl2中燃烧;⑥浓H2SO4稀释;⑦酸碱中和反应
A.①②⑤ B.①⑤⑦ C.①④⑤⑥⑦ D.③⑥⑦
难度: 中等查看答案及解析
-
美国航天局宣布,月球坑观测和传感卫星获得的撞月数据显示,月球上存在“数量可观的水”。下列有关说法正确的是( )
A.月球上的H2O分子中只含有非极性共价键
B.H2O在化学反应中既可作氧化剂又可作还原剂
C.氢的三种同位素H、D、T与16O只能形成三种水分子
D.在标准状况下,1mol水的体积约是22.4L
难度: 中等查看答案及解析
-
类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是( )
A.由2Cu + O2=2CuO可推出同族的硫也有Cu + S=CuS
B.Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为PbO·Pb2O3
C.Na能与水反应生成H2,K、Ca也能与水反应生成H2
D.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2
难度: 中等查看答案及解析
-
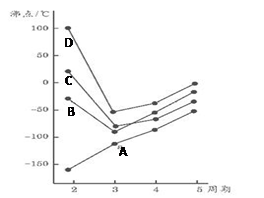
2010年3月30日,我国研究人员发表报告认为,全球将有1.4亿人因为用水而受到砷中毒之害、导致更多的人患癌症。海带含砷超标,经水浸泡24小时后,其含砷量才能达到食用安全标准。下列对砷(As)的有关判断正确的是 ( )
A.砷原子序数为33,第4周期第5A族 B.砷酸化学式为H2AsO4
C.砷化氢的稳定性比溴化氢的强 D.砷酸的酸性比硫酸的弱
难度: 中等查看答案及解析
-
下表各组物质中,不满足如图所示一步转化关系的选项是( )
选项 X Y Z
A. Cl2 NaCl HCl
B. Fe FeCl3 FeCl2
C. C CO CO2
D. Si SiO2 Na2SiO3
难度: 中等查看答案及解析
-
下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加入足量盐酸时,有气体产生
②液态的氟化氢中存在氢键,所以其分子比氯化氢更稳定
③二氧化硅是酸性氧化物,能与强碱反应,但也能与某种酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤Fe3+有氧化性,所以FeCl3溶液可用于回收废旧电路板中的铜
⑥实验室用NH4Cl和Ca(OH)2制备NH3涉及氧化还原反应
A.①②⑤ B.①③⑤ C.②④⑥ D.①②③
难度: 中等查看答案及解析
-
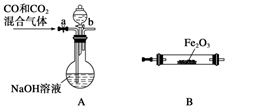
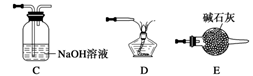
下列装置或操作能达到实验目的的是 ( )

I II III IV
A.实验I:中和热测定
B.实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验IV:可用于HCl气体的吸收
难度: 中等查看答案及解析
-
下列除杂质(括号内为杂质)方法不合理的是( )
A.Fe2+(Fe3+),加过量铁粉,过滤
B.Mg(Al),加过量NaOH溶液,过滤
C.(HCl),过量饱和,洗气
D.食盐(碘),加热,升华
难度: 中等查看答案及解析
-
下列设计与离子反应方程式书写均正确的是( )
A.磁性氧化铁溶于氢碘酸:Fe3O4+8H+
2Fe3++Fe2++4H2O
B.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2
2NH4++SO32-+H2O
C.用浓盐酸酸化的高锰酸钾溶液与过氧化氢反应:2MnO4- +5H2O2 + 6H+
2Mn2+ +5O2↑ + 8H2O
D.用氨水洗涤试管内壁的银镜:Ag++2NH3·H2O
[Ag(NH3)2]++2H2O
难度: 中等查看答案及解析
-
阿伏加德罗常数为NA,下列叙述中不正确的是 ( )
①12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA
②0.5 mol·L—1 Mg(NO3)2溶液中含有为2NA
③7.8 g Na2S和Na2O2的固体混合物中含有的阴离子数大于0.1NA
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA
⑤足量Fe与0.1 mol氯气反应时失去的电子数为0.3 NA
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦agC2H4和C3H6的混合物所含共用电子对数目为3aNA/14
A.①④⑦ B.①③④⑤⑥ C.②③⑤⑥ D.③④⑤⑥
难度: 困难查看答案及解析
-
在t℃时,将a gNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/cm3,质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数w=(1000a/17V)100%
B.溶质的物质的量浓度c=1000a/17V (mol/L)
C.溶液中c(OH-)=b/V (mol/L)
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w
难度: 中等查看答案及解析
-
工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl=CuCl2+H2O
FeO+2HCl=FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是 ( )
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化成Fe3+,再调整pH在3~4
D.通入硫化氢,使Fe2+直接沉淀
难度: 中等查看答案及解析
-
下列有关实验操作的说法正确的是( )
A.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
B.用蒸馏水将PH试纸先润湿,可用于检验氨气
C.可用瓷坩埚熔化各种钠的化合物
D.某溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则
难度: 中等查看答案及解析
-
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
A.a点的溶液呈中性
B.b点到c点之间发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— =Al(OH)3↓+2BaSO4↓
C.c点加入Ba(OH)2溶液的体积为200 mL
D.c点溶液呈碱性
难度: 困难查看答案及解析
-
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质丙和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物M,该物质溶于氢氧化钠溶液。化合物乙是工业制取硝酸的原料之一,乙在催化剂存在下可分解得到H2和另一种单质气体丁。下列说法正确的是( )
A.工业上制备单质丙的方法是电解其氯化物
B.丙丁元素形成化合物可用于制作新型陶瓷
C.甲与水的反应中,水做还原剂
D.单质丙也可以与氢氧化钠反应,并生成白色沉淀物M
难度: 中等查看答案及解析
-
已知
与足量的2mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )
A.反应中硫酸作氧化剂
B.
中硫元素被氧化
C. 1mol
完全反应转移0.5mol电子
D.刺激性气味的气体是氨气
难度: 中等查看答案及解析
-
将一定质量的铜粉加入到100mL,某浓度的稀硝酸中充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体336mL(标准状况) 。然后向上述混合物中加入稀硫酸至不再反应为止容器剩有铜粉m2g,则m1-m2为( )
A.5.76 B.2.88 C.1.44 D.4.32
难度: 中等查看答案及解析
-
将某200ml MgCl2、K2SO4 、(NH4)2SO4的混合溶液分成两等份,取一份加入含a mol氯化钡溶液,刚好使硫酸根沉淀完全,继续加入含b mol硝酸银溶液,刚好使氯离子沉淀完全,另取一份加入含c mol氢氧化钠的溶液,恰好完全反应,则该溶液中的钾离子
的浓度为( )
A.10(b+2a-c) B.(2b-c)/0.3 C.(2b-a+c)/0.3 D. 10(b-c)
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4︰3, Z原子比X原子的核外电子数多4。下列说法正确的是 ( )
A.W、Y、Z的氢化物稳定性顺序可能是W>Z>Y
B.W、X、Y、Z的原子半径大小顺序Z<Y<X<W
C.Z的氧化物对应水化物的酸性一定强于W氧化物对应水化物的酸性
D.Z的某种氧化物可以做新型消毒剂
难度: 困难查看答案及解析
-
下列热化学方程式或说法正确的是 ( )
A.甲烷的燃烧热为△H=-890kJ·mol-1,则
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H=-38.6kJ∙mol-1
C.已知:H2(g)+F2(g) = 2HF(g) △H= —270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和
难度: 中等查看答案及解析