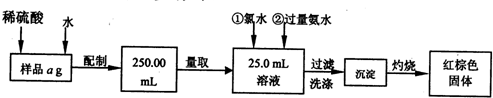
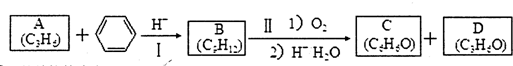-
日本福岛第一核电站发生严重的核辐射泄漏,主要泄露的物质有碘-13l(即131I),人体甲状腺吸收它后,在短时间内会造成损伤致使其细胞癌化.日本政府向福岛核电站附近居民发放碘片,碘片含天然碘-127(即127I),以降低放射性碘对人体的伤害.已知放射性碘-13l的核电荷数为53,则下列说法不正确的是( )
A.碘-131与人体所需的天然碘-127的化学性质基本一致
B.服用碘片,以减少或阻断人体对I-13l的吸收,其原理与化学平衡有关
C.具有放射性的碘-13l原子比天然碘-127原子多4个中子
D.碘-13l原子有7个电子层难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A.10g质量分数为46%的乙醇溶液中,氧原子总数为0.4NA
B.92gC3H8O3和C7H8的混合物,完全燃烧生成H2O分子为4NA
C.0.lmol石墨晶体中存在的C-C键数目为0.2NA
D.18g重水(D216O)所含质子数为9NA难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.用两根铁棒作电极电解饱和食盐水:2Cl-+2H2O═2OH-+H2↑+Cl2↑
B.向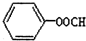 中加入足量的氢氧化钠溶液并加热:
中加入足量的氢氧化钠溶液并加热: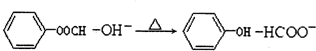
C.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+=Ca2++CO2↑+H2O
D.硫酸和过氧化氢混合溶液蚀刻印刷铜板:Cu+H2O2+2H+=Cu2++2H2O难度: 中等查看答案及解析
-
已知:①氯气、单质硫分别跟氢气反应的热化学方程式如下:
H2(g)+Cl2(g)=2HCl(g);△H1=-Q1 kJ/mol H2(g)+S(s)=H2S(g);△H2=-Q2kJ/mol②25℃,10l kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol 下列说法正确的是( )
A.氢气的燃烧热为:QlkJ/mol
B.Ql>Q2
C.氯气与硫化氢气体反应的热化学方程式:Cl2(g)+H2S(g)=2HCl(g)+S(s);△H2=-(Q2一Q1)kJ/mol
D.KOH(aq)+HCl(g)=KCl(aq)+H2O(1);△H=-57.3kJ/mol难度: 中等查看答案及解析
-
在常温下,已知两种一元弱酸的酸性:HX>HY,下列说法不正确的是( )
A.在等体积和等浓度的HX与NaY相混合的溶液中:c(HY)+c(H+)=C(X-)+c(OH-)
B.同浓度的NaX和NaY两种溶液中:[c(X-)+c(OH-)]NaX溶液=[c(Y-)+c(OH-)]NaY溶液
C.在常温下,当NaX溶液的pH=8时:c(Na+)-c(X-)=9.9×10-7mol/L
D.在相同浓度的HX与HY溶液中:c(HY)>c(HX)>c(H+)>c(X-)>c(Y-)>c(OH-)难度: 中等查看答案及解析
-
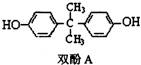
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种:
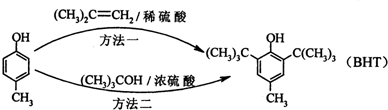
下列说法正确的是( )
A.BHT置于空气中不易被氧化
B.两种方法的反应类型都是加成反应
C.与BHT互为同系物
D.(CH3)3COH在浓硫酸存在下发生消去反应的产物有两种难度: 中等查看答案及解析
-
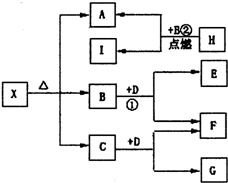
已知反应:3A(g)+B(g)
C(s)+4D(g);△H=-Q kJ/lmol下列分析错误的是( )

A.在恒温密闭容器中,共加入1molA和B的混合物,发生反应,当A的转化率与B的转化率相等时,则最初加入B的量为0.25mol
B.在恒温下,加入过量的C和1mol的D反应达到平衡后,再加入1molD,同时压强再增大一倍,建立起新的化学平衡后,A的浓度将增加到原平衡的4倍
C.如果在C(s)中含有难熔性的杂质,将其放在下列装置的b点处,并充入一定量的D(g),一段时间后,可在a点处得到纯C(S)
D.当反应向逆反应方向进行时,v逆(B)>3v(A)正难度: 中等查看答案及解析
-
将a mol Cu2S与b mol FeS的混合粉末投入到V mL、c mol/L的硝酸溶液中恰好完全反应,生成d L NO气体,所得溶液可看作是硝酸铜、硝酸铁和硫酸的混合溶液,则反应中被还原的硝酸可能是( )
A.mol
B.(cV-4a-2b)mol
C.(4a+3b)mol
D.mol
难度: 中等查看答案及解析