-
下列说法正确的是( )
A.伴有能量变化的物质变化都是化学变化
B.吸热反应一定需要加热才能发生
C.凡是放热反应的发生均无需加热
D.物质发生化学反应都伴随着能量变化
难度: 简单查看答案及解析
-
下列粒子半径最小的是( )。
A.Na+ B.Na C.Cl D.Cl-
难度: 简单查看答案及解析
-
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已相继被发现。下列有关说法中,正确的是( )
A.H2和H3属于同位素 B.O2和O4属于同素异形体
C.C60是共价化合物 D.N5+中含有36个电子
难度: 中等查看答案及解析
-
根据图中包含的信息分析,下列叙述正确的是 ( )

A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B.436kJ•mol-1是指断开1 mol H2中的H—H键需要放出436 kJ的能量
C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D.431 kJ•mol-1是指生成2mol HCl中的H—Cl键需要放出431 kJ的能量
难度: 中等查看答案及解析
-
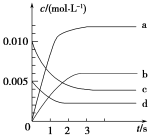
在一定温度下,向体积恒定为2 L的密闭容器里充入2 mol M和一定量的N,发生如下反应:M(g)+N(g)
E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2 mol·L-1。下列说法正确的是( )
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8mol·L-1·min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6mol·L-1
难度: 困难查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的,下列说法中正确的是( )
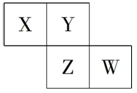
A.阴离子的半径从大到小排列顺序为:X>Y>Z>W
B.X、Y、Z、W元素的氢化物分子间都可以形成氢键
C.Y的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:W>Z
难度: 中等查看答案及解析
-
已知某可逆反应在密闭容器中进行:( )
A(g)+2B(g)
3C(g)+D(s)(正反应为放热反应),图2-28中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是( )

A.增大A的浓度 B.扩大容器的容积
C.加入催化剂 D.升高温度
难度: 中等查看答案及解析
-
下列实验不能达到预期目的的是( )
序号
实验操作
实验目的
A
Cl2、Br2分别与H2反应
比较氯、溴的非金属性强弱
B
MgCl2、AlCl3溶液中分别通入NH3
比较镁、铝的金属性强弱
C
测定相同浓度H2CO3、H2SO4两溶液的pH
比较碳、硫的非金属性强弱
D
Fe、Cu分别与盐酸反应
比较铁、铜的金属性强弱
难度: 中等查看答案及解析
-
如图中的大黑点代表原子序数为1~18的元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是 ( )
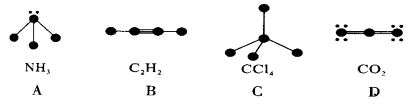
难度: 中等查看答案及解析
-
aXn和bYm为两主族元素的离子,它们的电子层结构相同,下列判断错误的是( )。
A.原子半径:X<Y
B.a+n=b-m
C.Y最高价氧化物的化学式为YOm
D.X的氢化物的化学式为HnX
难度: 中等查看答案及解析
-
下列电子式书写正确的是( )
①氧原子· · ②过氧根离子[]- ③氢氧根离子[H]-
④钠离子[Na]+ ⑤氢离子H+ ⑥铵根离子[HH]+
⑦铝原子· ·⑧溴离子[]-
A.①②③⑥⑦ B.①③④⑥⑦⑧
C.①③⑤⑥⑦⑧ D.②③④⑦⑧
难度: 中等查看答案及解析
-
100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
A.①③ B.②③ C.①④ D.②④
难度: 中等查看答案及解析
-
在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应A(s)+2B(g)
C(g)+D(g) 已达到化学平衡状态的是
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度④混合气体总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值⑦混合气体总质量
A.②③⑤⑦ B.③④⑤⑥ C.①③④⑤ D.①④⑦
难度: 中等查看答案及解析
-
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
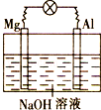
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
难度: 中等查看答案及解析
-
将N2、H2的混合气体分别充入甲、乙、丙三个容器后,测得化学反应速率分别为甲:v(H2)=3 mol/(L·min);乙:v(N2)=2 mol/(L·min);丙:v(NH3)=1 mol/(L·min)。则三个容器中合成氨的反应速率( )
A.v(甲)>v(乙)>v(丙) B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙) D.v(乙)>v(甲)>v(丙)
难度: 中等查看答案及解析
-
在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是( )
A.x=1
B.B的转化率为80%
C.2min内A的平均反应速率为0.3 mol·(L·min)-1
D.若混合气体的密度不变,也不能明该反应达到平衡状态
难度: 困难查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
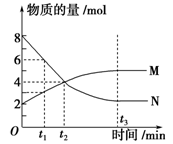
A.化学方程式:2M
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
难度: 中等查看答案及解析
-
在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1~t4s时测得各物质的浓度如表,则下列判断正确的是( )
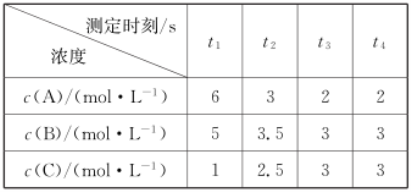
A.在t3s时反应已经停止
B.t3~t4s内正、逆反应速率不相等
C.在容器中发生的反应为A+B
C
D.在t3s时,已达到平衡状态
难度: 中等查看答案及解析