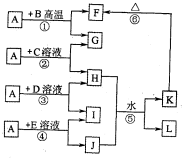
-
下列说法正确的是( )
A.由于H2O分子间存在氢键,所以H2O比H2S稳定
B.11.2LO2和CO2的混合气体中含有6.02×1023个氧原子
C.固态NaCl不导电,是由于NaCl晶体中不存在阴、阳离子
D.可逆反应达平衡状态后,化学反应速率发生变化,平衡不一定移动难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变难度: 中等查看答案及解析
-
下列说法正确的是( )
A.金属腐蚀就是金属原子失去电子被还原的过程
B.将金属a与外加直流电源的正极相连,而将负极接到废铁上,可防止金属a被腐蚀
C.钢铁电化学腐蚀时,负极反应式为:2H2O+O2+4e=4OH-
D.氯碱工业中,阳极发生的反应为:2Cl--2e=Cl2↑难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.某非金属元素从游离态变成化合态时,该元素一定被还原
B.气态氢化物的稳定性:HF>HCl,是因为H-F的键能大于H-Cl
C.NF3分子的结构是三角锥形,分子中三个N-F键的性质完全相同,故NF3分子是非极性分子
D.分子晶体在状态变化或溶于水的过程中,均不会破坏化学键难度: 中等查看答案及解析
-
根据下列实验现象,所得结论不正确的是( )
实验 实验现象 结论 A 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 活动性:Al>Fe>Cu B 左边棉花先变橙色再变无色,右边棉花先变蓝色后变无色 氧化性:Cl2>Br2,Cl2>I2 C 白色固体先变为淡黄色,后变为黑色 溶解性:AgCl>AgBr>Ag2S D 锥形瓶中有气体产生,烧杯中液体有浑浊现象 非金属性:Cl>C>Si
A.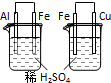
B.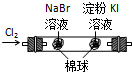
C.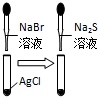
D.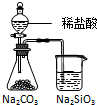
难度: 中等查看答案及解析
-
下列比较中,正确的是( )
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.0.2mol•L-1NH4Cl和0.1mol•L-1NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D.同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O;c(NH4+)由大到小的顺序是:①>②>③>④难度: 中等查看答案及解析
-
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+O2(g)=H2O(l)△H3=-285.8kJ•mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为( )kJ•mol-1.
A.+488.3
B.-244.15
C.-488.3
D.+244.15难度: 中等查看答案及解析
-
以下是分离乙酸乙酯、乙酸、乙醇的混合物的流程图,图中圆括号内填入适当的试剂,方括号内填入适当的分离方法,方框内是有关物质的名称.下列说法正确的是( )

A.a为NaOH溶液,①为蒸馏
B.②、③均为蒸馏,①为分液
C.②为分液,C中含有醋酸钠
D.b可以是硫酸,也可以是盐酸难度: 中等查看答案及解析