-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.③④⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.⑤⑥⑦⑧
难度: 简单查看答案及解析
-
下列反应的反应热ΔH>0的是
A.氢氧化钠与盐酸反应 B.氢氧化钡晶体与氯化铵的反应
C.锌和盐酸的反应 D.碳的燃烧
难度: 中等查看答案及解析
-
已知:4NH3(g)+5O2(g)
4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则下列关系不正确的是
A.4v(NH3)=5v(O2) B.6v(O2)=5v(H2O)
C.3v(NH3)=2v(H2O) D.4v(O2)=5v(NO)
难度: 中等查看答案及解析
-
某反应4A(g)+5B(g)=4C(g)+6D(g),在四种不同情况下的反应速率分别为:
①υ(A)=0.4mol/(L·s);②υ(B)=0.6mol/(L·s);
③υ(C)= 0.8mol/(L·s);④υ(D)=1.0mol/(L·min)。该反应进行得最快的是
A.④ B.③ C.②③ D.①④
难度: 中等查看答案及解析
-
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入正催化剂
A.①②③ B.②③⑤ C.②⑤ D.②③④
难度: 中等查看答案及解析
-
运用相关化学知识进行判断,下列结论错误的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.常温下,0.1 mol/L氨水(电离度α=1%)的pH为11:
C.用蒸馏水润湿的试纸测溶液的pH,不一定会使结果偏低
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
难度: 中等查看答案及解析
-
一定量的Zn与过量的稀硫酸反应制取氢气,一定温度下为了加快反应速率而不影响氢气的量,可向其中加入
A.KNO3固体 B.Zn粉 C.Cu粉 D.CH3COONa晶体
难度: 中等查看答案及解析
-
下列说法正确的是
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.根据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化
难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
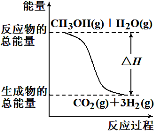
根据上述反应,下列说法正确的是
A.反应①中的能量变化如图所示
B.可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D.CH3OH转变成H2的过程一定要吸收能量
难度: 中等查看答案及解析
-
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是
纯净物
混合物
强电解质
弱电解质
非电解质
A
盐酸
玻璃
硫酸
氨水
干冰
B
氢氧化钡
蔗糖溶液
硫酸钡
醋酸
水
C
胆矾
浓硫酸
氧化钙
水
二氧化碳
D
硝酸
盐酸
硫酸
醋酸
氢气
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1∶c2=3∶1
难度: 中等查看答案及解析
-
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g)。下列叙述正确的是
A.当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态
B.当平衡向正方向移动时,平衡常数一定增大
C.增大压强,可提高CO2和H2的转化率
D.相同条件下,2 mol氢原子所具有的能量等于1 mol氢分子所具有的能量
难度: 中等查看答案及解析
-
下列溶液肯定呈酸性的是
A.含H+的溶液 B.加酚酞显无色的溶液
C.pH<7的溶液 D.c(OH―) <c(H+)的溶液
难度: 中等查看答案及解析
-
某学生中和滴定实验过程为:
(a)取碱式滴定管;(b)用蒸馏水洗净;(c)立即加入待测的NaOH溶液;(d)记录液面刻度读数;
(e)用酸式滴定管精确放出一定量标准酸液加入到只用蒸馏水洗涤过的锥形瓶中;
(f)向锥形瓶中加入适量蒸馏水;(g)加入酚酞试液2滴;(h)滴定时边摇动锥形瓶;
(i)边注视滴定管内液面变化;(j)当滴到溶液由无色变到粉红色时,立即停止滴定;
(k)记录液面刻度读数;(m)根据重复两次滴定的耗NaOH溶液体积平均值为22mL,
上述实验过程中错误之处有
A.c、d、f、j、k B.c、i、j、m
C.e、f、i、m D.c、e、f、i、j、m
难度: 中等查看答案及解析
-
对可逆反应:2A(g)+B(s)
3C(s)+2D(g);ΔH>0。下图所示为正逆反应速率(v)与时间(t)关系的示意图,
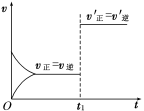
如果在t1时刻改变以下条件:
①加入A;②加入催化剂;③加压;④升温;⑤减少C符合图示的条件是
A.②③ B.①② C.③④ D.④⑤
难度: 中等查看答案及解析
-
已知化学反应A2(g) + B2(g) =2AB(g)的能量变化如图所示,
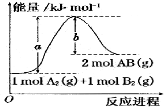
下列叙述中正确的是
A.该反应热△H=+(a-b)kJ/mol
B.缩小体积增大压强,A的物质的量浓度不变
C.该反应为放热反应
D.加入催化剂可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g)+O2(g)=2H2O(g) △H1;2H2(g)+O2(g)=2H2O(l) △H2
B.S(g)+O2(g)=SO2(g)△H1;S(s)+O2(g)=SO2(g) △H2
C.C(s)+
O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g) △H2
D.H2(g)+Cl2(g)=2HCl(g)△H1;2H2(g)+2Cl2(g)=4HCl(g) △H2
难度: 中等查看答案及解析
-
已知:强酸和强碱在稀溶液中发生反应时的中和热为57.3 kJ · mol-1,101 k Pa时辛烷的燃烧热为5518 kJ·mol-1。则下列热化学方程式书写正确的是
A.H++OH-=H2O △H = -57.3kJ·mol-1
B.2NaOH(aq)+ H2SO4(aq)= Na2SO4(aq)+2H2O(l) △H = -114.6 kJ·mol-1
C.2C8H18(l) + 25O2(g) = 16CO2(g)+18H2O(g) △H = -11036 kJ·mol-1
D.2C8H18(l) + 25O2(g) = 16CO2(g)+18H2O(l) △H = -5518kJ·mol-1
难度: 中等查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+O2(g)在体积固定的密闭容器中进行,能判断达到平衡状态的标志的是
①单位时间内生成n mol O2的同时生成2n mol NO2
②生成O2的速率等于生成NO2的速率
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤ C.①③④⑤ D.全部
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X(g)+3Y(g)
2Z(g),有关下列图像的说法正确的是

A.依据图a可判断正反应为放热反应
B.在图b中,虚线可表示升高温度
C.若正反应的ΔH<0,图c可表示降低温度使平衡向逆反应方向移动
D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
难度: 中等查看答案及解析
-
某反应A + B = C + D 在低温下能自发进行,在高温下不能自发进行,对该反应过程△H、△S的判断正确的是
A.△H <0、△S >0 B.△H >0、△S >0
C.△H <0、△S <0 D.△H >0、△S <0
难度: 简单查看答案及解析
-
下列叙述正确的是
A.25℃,某醋酸溶液的pH=a,将此溶液稀释到100倍后,溶液的pH=b,则a=b-2
B.在氨水的溶液中再加水,
将变大
C.25℃ 0.5×10-3 mol/L硫酸的pH=3.0,升高温度溶液pH增大
D.25℃,浓度为0.1 mol/L盐酸溶液,水电离出的c(H+)为0.1 mol/L
难度: 中等查看答案及解析
-
把0.05 mol NaOH固体分别加入到下列100 mL溶液中,导电能力变化较大的是
A.0.5 mol/L的CH3COOH溶液 B.0.5 mol/L盐酸
C.0.5 mol/LCuSO4溶液 D.0.5 mol/L NH4NO3溶液
难度: 中等查看答案及解析
-
下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.物质的量浓度相同的磷酸钠(Na3PO4)溶液和磷酸(H3PO4)溶液中PO43-的物质的量浓度相同
C.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等
D.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少
难度: 中等查看答案及解析
-
用50 mL 0.55 mol/L盐酸与50 mL 0.50 mol/L NaOH溶液进行中和热测定的实验,测量结果偏高的原因可能是
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
难度: 中等查看答案及解析
-
现有常温时pH=1的某强酸溶液10 mL,下列操作能使溶液pH变成2的是
A.加水稀释成100 mL
B.加入10 mL水进行稀释
C.加入10 mL 0.01 mol·L-1的NaOH溶液
D.加入10 mL 0.01 mol·L-1的HCI溶液
难度: 中等查看答案及解析
-
(4分)a1,a2分别为A在两个恒容容器中平衡体系A(g)
2B(g) 和A(g)
B(g)的转化率,在温度不变的情况下,均增加A(g)的物质的量,则 a1_______,a2______,(填“减小”或“增大”或“不变”)
难度: 中等查看答案及解析