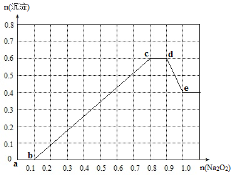
-
下列物质的俗名与化学式不对应的是
A、硅石——SiO2 B、硫铁矿——FeS2
C、纯碱——NaOH D、芒硝——Na2SO4·10H2O
难度: 简单查看答案及解析
-
下列除杂操作可行的是
A、通过浓硫酸除去HCl中的H2O
B、通过灼热的CuO除去H2中的CO
C、通过灼热的镁粉除去CO2中的N2
D、通过饱和碳酸氢钠溶液除去Cl2中的HCl
难度: 中等查看答案及解析
-
下列有关物质的应用不恰当的是
A、氧化铝可用作耐火材料
B、氧化铁可用作红色油漆和涂料
C、浓氨水可检验氯气管道漏气
D、二氧化硫可用于食品增白
难度: 简单查看答案及解析
-
下列叙述错误的是
A、SO2使品红溶液褪色与Cl2使品红溶液褪色的原理不同
B、利用焰色反应可以鉴别KCl和NaCl
C、利用澄清石灰水可以鉴别NaHCO3溶液和Na2CO3溶液
D、用AgNO3溶液和稀硝酸可以鉴别KCl和K2CO3
难度: 简单查看答案及解析
-
下列关于气体的实验室制取方法,说法正确的是
A、可用加热试管中的NH4Cl制取NH3
B、可用MnO2固体和稀盐酸共热制取Cl2
C、可用炽热的碳和浓硫酸反应制取SO2
D、可用铝箔和NaOH溶液反应制取H2
难度: 简单查看答案及解析
-
下列反应的方程式正确的是
A、浓盐酸与铁屑反应的离子方程式:2Fe + 6H+ = 2Fe3+ + 3H2↑
B、钠与CuSO4溶液反应的离子方程式:2Na + Cu2+ = Cu↓+ 2Na+
C、NaHCO3溶液与NaOH反应的离子方程式:HCO3—+ OH—= H2O+ CO2↑
D、将CO2通入饱和碳酸钠溶液直至过量的离子方程式:
2Na+ + CO2 + CO32- + H2O = 2NaHCO3↓
难度: 中等查看答案及解析
-
将2.8 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,设溶液体积不变,关于其结果说法正确的是
A、铁粉与氯化铁恰好完全反应,Cl- 基本保持不变
B、往溶液中滴入无色KSCN溶液,溶液变红色
C、氧化产物和还原产物的物质的量之比为1: 2
D、反应后溶液中Fe2+ 离子的浓度为 4 mol·L-1
难度: 简单查看答案及解析
-
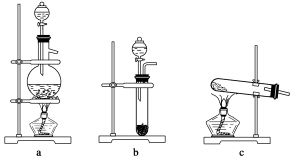
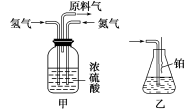
下列关于实验室制取SO2的实验,其中叙述正确的是
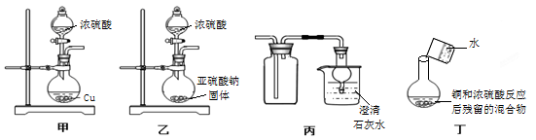
A、可用甲图中装置和药品制取SO2
B、可用乙图中装置和药品制取SO2
C、可用丙图中装置和药品收集二氧化硫并吸收尾气
D、可用丁图中装置和药品检验铜和浓硫酸反应生成的CuSO4
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
实验
现象
结论
A
将氯气通入品红溶液
溶液红色褪去
氯气具有漂白性
B
将铜粉加入1.0mol·L-1
的Fe2(SO4)3溶液中
溶液变蓝,有黑色固体出现
金属Fe比Cu活泼
C
用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点比较低
D
向盛有少量浓硝酸、稀硝酸的两支试管中分别加入一片大小相同的铜片
浓硝酸中铜片很快开始溶解,并放出红棕色气体;稀硝酸中过一会铜片表面才出现无色气体,气体遇空气变红棕色
浓硝酸氧化性强于稀硝酸
难度: 简单查看答案及解析
-
加热条件下把16.8 g铁粉完全溶解于100 mL某浓度的硝酸中,如反应只收集到0.4 mol NO2和0.1 mol NO,下列说法不正确的是
A、反应后溶液中NO3- 的物质的量为0.7 mol
B、硝酸有剩余,铁粉反应完
C、反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶2
D、该硝酸的浓度为12 mol·L-1
难度: 简单查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
。下列有关物质的推断不正确的是
A、若甲为焦炭,则丁可能是O2
B、若甲为SO2,则丁可能是氨水
C、若甲为Fe,则丁可能是氯气
D、若甲为NaOH 溶液,则丁可能是CO2
难度: 简单查看答案及解析
-
水溶液中能大量共存的一组离子是
A、Na+ 、Al3+ 、Cl- 、SO42- B、H+ 、Na+ 、Fe2+ 、NO3-
C、K+ 、Cu2+ 、NO3- 、OH- D、H+ 、NH4+、AlO2- 、SO42-
难度: 简单查看答案及解析
-
下列实验的现象与对应结论均正确的是
操作
现象
结论
A
将水蒸气通过灼热的铁粉
粉末变红
铁与水在高温下发生反应
B
常温下将表面用砂纸打磨过的Al片放入浓硝酸中
无明显变化
Al与浓硝酸不反应
C
将SO2气体通入硫酸酸化的高锰酸钾溶液中
溶液紫色褪去
SO2具有漂白性
D
将浓硫酸滴到蔗糖表面
固体变黑膨胀
浓硫酸有脱水性和强氧化性
难度: 简单查看答案及解析
-
将NaHCO3和部分风化的碳酸钠晶体组成的混合物样品m克配成1.00 L溶液,取50.0mL上述溶液,加入0.200 mol·L-1盐酸至恰好完全反应时,用去盐酸50.0mL。若将上述样品m克加热至质量不变时,可得到固体的质量为
A、0.53g B、5.30g C、10.6g D、11.7g
难度: 困难查看答案及解析
-
将一定质量的铜粉加入到100 mL某浓度的稀硝酸中,充分反应后,容器中剩有m1 g铜粉,此时共收集到NO气体560 mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉m2 g,则(m1-m2)为
A、7.2 B、2.4
C、0 D、缺少条件,无法计算
难度: 极难查看答案及解析
-
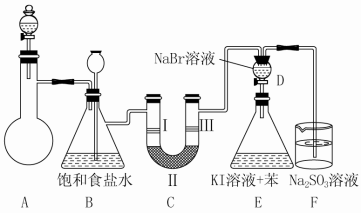
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
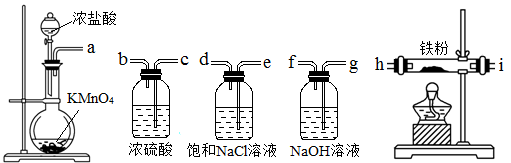
A、a-e-d-c-b-h-i-g B、a-d-e-c-b-h-i-g
C、a-e-d-h-i-g-f-c D、a-b-c-d-e-f-g-h
难度: 困难查看答案及解析