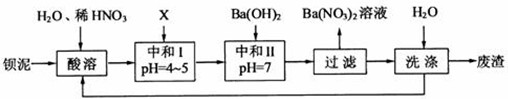
-
化学与生活、社会密切相关,下列说法正确的是( )
A.淀粉属于糖类物质,遇碘元素变蓝色
B.中国第1艘LNG船“大鹏昊”已于2009年5月2日满载65000吨LNG,抵达广东.船底镶嵌锌块,锌作正极,以防船体被腐蚀
C.上海世博会某些场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
D.医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于水难度: 中等查看答案及解析
-
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍.则下列判断正确的是( )
A.两种单质的摩尔质量比为1:4
B.生成物C中A的质量分数为75%
C.生成物C中A、B的原子个数比为3:1
D.反应前后气体分子数比为1:4难度: 中等查看答案及解析
-
下列说法中,正确的是( )
①分别加热蒸干灼烧NaAlO2溶液和AlCl3溶液,最终都能得到Al2O3
②MgO、Al2O3的熔点很高,工业上用于制作耐高温材料
③20gH218O完全分解时转移电子数为2NA
④Ksp不仅与难溶电解质的性质和温度有关,而且与溶液中的离子浓度有关
⑤乙醇、明矾属于纯净物,矿泉水、食醋属于混合物
⑥食盐可以融冰化雪,用食盐作融雪剂不会对环境产生任何危害
⑦硫酸、苛性钠、纯碱和生石灰分别属于酸、碱、盐和氧化物.
A.①③④⑦
B.②⑥⑦
C.②③⑤⑦
D.②③⑤难度: 中等查看答案及解析
-
下列各组离子可能大量共存的是( )
A.含有大量NO3-的澄清透明溶液中:K+、Cu2+、Cl-、Na+
B.能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C.常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、HCO3-、SO42-、Cl-
D.pH=7的溶液:Fe3+、Mg2+、SO42-、Cl-难度: 中等查看答案及解析
-
《化学教育》报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件.这足以说明,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”.“瘦肉精”的结构可表示如图,下列关于“瘦肉精”的说法中正确的是( )
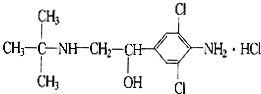
A.摩尔质量为313.5 g
B.属于芳香烃
C.不能发生加成反应
D.分子式为C12H19Cl3N2O难度: 中等查看答案及解析
-
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献.已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应.(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2.)下列说法正确的是( )
A.铈溶于氢碘酸的化学方程式可表示为:Ce+4HICeI4+2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+═Ce3++2Fe3+
C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D.四种核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同素异形体难度: 中等查看答案及解析
-
合成氨反应为:N2(g)+3H2(g)⇌2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是( )
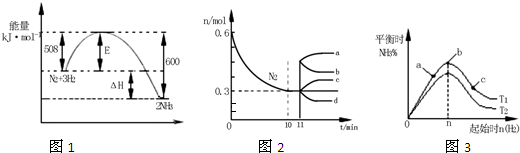
A.由图1可知2NH3(g)N2(g)+3H2(g)△H=-92kJ•mol-1
B.图2中0~10min内该反应的平均速率v(H2)=0.045mol•L-1•min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2难度: 中等查看答案及解析