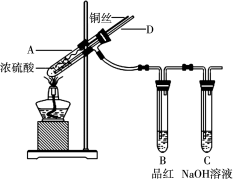
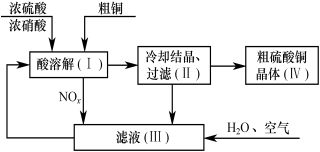
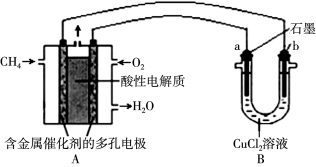
-
下列化学用语正确的是
A.重水的分子式H218O B.Mg2+的结构示意图
C.乙酸的结构式CH3COOH D.次氯酸的电子式
难度: 中等查看答案及解析
-
下列变化不属于取代反应的是
A.CH3COOC2H5+H2O
CH3COOH+C2H5OH B.CH3=CH2+H2
CH3CH3
C.
+HNO3
+H2O D.CH4+Cl2
CH3Cl+HCl
难度: 中等查看答案及解析
-
下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B.能自发进行的化学反应,一定是△H<0、△S>0
C.焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化
D.钢铁发生电化学腐蚀时,负极的电极反应式为 Fe–3e- = Fe3+
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,46 g NO2与 N2O4的混合气体中含有的分子总数为NA
B.0.1 mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3 NA
C.25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA
D.一定量的钠与8 g氧气作用,若两者均无剩余,转移的电子数为NA
难度: 中等查看答案及解析
-
用下列装置进行实验,设计正确且能达到实验目的的是
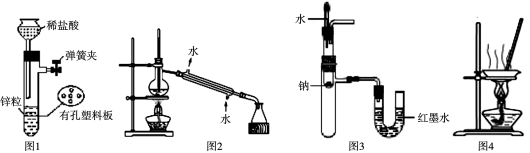
A.用图1所示装置制取少量H2
B.用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
C.用图3所示装置验证Na和水反应为放热反应
D.用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
难度: 中等查看答案及解析
-
有机物A的产量是衡量一个国家石油工业发展水平的标志,可发生以下系列转化, B、D是生活中常见的两种有机物,下列说法不正确的是
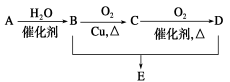
A.A的结构简式为CH2=CH2
B.1molB物质可以与足量Na反应生成0.5molH2
C.B、D、E三种物质可以用饱和Na2CO3溶液鉴别
D.由B、D制备E浓H2SO4只作吸水剂
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中能大量共存的是
A.滴入甲基橙显红色的溶液中:NH4+、Ba2+、AlO2-、Cl-
B.PH=13的溶液:Na+、K+、SiO32-、HCO3-
C.含较多的SO32-的溶液:H+、Ca2+、Fe3+、NO3-
D.澄清透明溶液中:K+、MnO4-、H2O、SO42-
难度: 中等查看答案及解析
-
某反应的反应过程中能量变化如下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
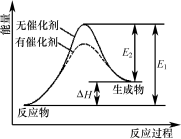
A.该反应为放热反应 B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能 D.逆反应的活化能大于正反应的活化能
难度: 中等查看答案及解析
-
根据下图的转化关系判断下列说法正确的是(反应条件已略去)
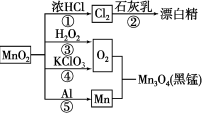
A.反应①②③④⑤均属于氧化还原反应和离子反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
难度: 中等查看答案及解析
-
如图是立方烷的球棍模型,下列有关说法不正确的是

A.其一氯代物只有一种
B.其二氯代物有三种同分异构体
C.它的分子式不符合CnH2n+2,所以它不是饱和烃
D.它与苯乙烯(C6H5—CH=CH2)互为同分异构体
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是

A.若甲为N2,则丁可能是O2 B.若甲为Fe,则丁可能是Cl2
C.若甲为AlCl3,则丁可能是NH3 D.若甲为NaHCO3,则丁可能是HCl
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH- =BaSO4↓+2H2O
B.向FeCl2溶液中通入氯气:Fe2+ + Cl2 = Fe3+ + 2Cl-
C.向Ca(ClO)2溶液中通入过量的SO2:C1O- + SO2 + H2O=HClO + HSO3-
D.FeSO4酸性溶液中加H2O2:2Fe2++H2O2=2Fe3++2OH-
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)
2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.反应前2 min的平均速率ν(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)<0.24 mol
D.其他条件不变,向平衡体系中再充入0.16 mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大
难度: 中等查看答案及解析
-
常温下,下列各溶液的叙述中正确的是
A.NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-)
B.0.1 mol/L的醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液显酸性:
c(CH3COO-)>c(CH3COOH) >c(Cl-)>c(H+)
C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D.向1.00 L 0.3 mol/L NaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
难度: 中等查看答案及解析