-
下列现象或应用与胶体性质无关的是
A. 将盐卤或石膏加入豆浆中,制成豆腐
B. 冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用
D. 用半透明可以除去淀粉溶液中的少量NaCl
难度: 中等查看答案及解析
-
分析生产生活中的下列过程,不涉及氧化还原反应的是( )
A. 铜制品、铁制品在潮湿的空气中生锈
B. 缺铁性贫血服用补铁剂时,需与维生维C同时服用
C. 将氯气通入冷的消石灰中制漂白粉
D. 从海水中提取氯化镁
难度: 中等查看答案及解析
-
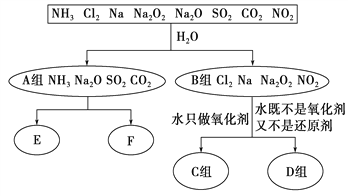
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
A. 冰醋酸、纯碱、蓝矾、生石灰分别属于酸、碱、盐、氧化物
B. HC1O、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸
C. 漂白粉、冰水、氯水均为混合物
D. Na2O、NaOH、NaCl、Na2SO4、Na2O2都属于钠的含氧化合物
难度: 简单查看答案及解析
-
“混盐”是指一种金属离子与多种酸根阴离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指多种简单阳离子和一种酸根阴离子构成的盐,如:KAl(SO4)2。下列化合物中属于“混盐”的是( )
A. BiONO3 B. (NH4)2Fe(SO4)2 C. Ca(ClO)Cl D. K3Fe(CN)6
难度: 简单查看答案及解析
-
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
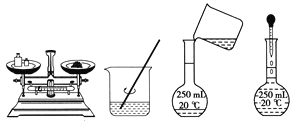
A. 称量 B. 溶解 C. 转移 D. 定容
难度: 简单查看答案及解析
-
用 NA 表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 通入1 molCl2的新制氯水中,HClO、Cl-、C1O-粒子数之和为2NA
B. 标准状况下,22.4 L CCl4 中所含分子数为 NA
C. 常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA
D. 0.1 mol Fe 和足量的稀硝酸充分反应,转移电子数为 0.3NA
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. c(OH-)=0.1mol/L的溶液:Na+、K+、CO32-、ClO-
B. 0.1mol/L的AlCl3溶液中:Na+、K+、CO32-、NO3-、
C. 无色透明溶液中:Ca2+、NH4+、Cu2+、SO42-
D. pH=1的溶液中: Fe2+、Cl-、NO3-、K+
难度: 困难查看答案及解析
-
下列离子方程式正确的是( )
A. NaHCO3溶液与NaOH溶液反应:H++OH-===H2O
B. 少量二氧化碳通入足量的NaOH溶液中:CO2+OH-===HCO3-
C. Fe与盐酸反应产生H2:2Fe+6H+===2Fe3++3H2↑
D. 氨水和醋酸溶液混合:NH3•H2O+CH3COOH===NH4++CH3COO-+H2O
难度: 困难查看答案及解析
-
实验中需用2.0mol•L-1的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为 ( )
A. 1 000mL;212.0g B. 500mL;100.7g
C. 1000mL;201.4g D. 100mL;21.2g
难度: 中等查看答案及解析
-
下列关于离子检验的说法中正确的是( )
A. 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl-
B. 向某溶液中加入稀盐酸,产生无色气体,则该溶液中一定含有CO
C. 向某溶液中加入NaOH溶液,用蓝色石蕊试纸检验逸出的气体,试纸变红,则该溶液中一定含有NH4+
D. 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制的氯水,溶液变为红色,则该溶液中一定含有Fe2+
难度: 困难查看答案及解析
-
在标准状况下, mg气体A与ng气体B的分子数相同。则与此有关的下列说法中不正确的是( )
A. 气体A与气体B的摩尔质量之比为m:n
B. 同温同压下,气体A与气体B的密度之比为n:m
C. 质量相同的气体A与气体B的分子数之比为n:m
D. 相同状况下,同体积的气体A与气体B的质量之比为m:n
难度: 困难查看答案及解析
-
已知下列反应:Co2O3+6HCl(浓)═2CoCl2+Cl2↑+3H2O (I) 5Cl2+I2+6H2O═10HCl+2HIO3 (II)
下列说法正确的是( )
A. 氧化性:Co2O3>Cl2>HIO3 B. 反应I中HCl是氧化剂
C. 还原性:CoCl2>HCl>I2 D. 反应Ⅱ中Cl2发生氧化反应
难度: 简单查看答案及解析
-
NH3和NO2在催化剂作用下反应:8NH3+6NO2=7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是( )
A. 转移电子3.6NA B. 生成气体的体积32.56 L(标准状况)
C. 还原剂比氧化剂多0.2 mol D. 被还原的氮原子是11.2 g
难度: 极难查看答案及解析
-
某溶液中可能含有OH-、CO32-、[Al(OH)4]-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是( )
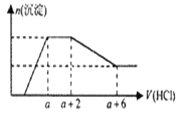
A. 原溶液中一定含有的阴离子是OH-、SiO32-、[Al(OH)4]-、CO32-
B. 反应后最终溶液中的溶质只有AlCl3
C. 原溶液中一定含有Na2SO4
D. 原溶液中含有CO32-与[Al(OH)4]-的物质的量之比为1:1
难度: 困难查看答案及解析
-
若20g密度为ρg·cm-3的Ca(NO3)2溶液中含有2gCa(NO3)2,则溶液中NO3-的物质的量浓度为( )
A.
B.
C.
D.
难度: 困难查看答案及解析
-
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与 NaClO的物质的量之比为1∶16,则x的值为 ( )
A. 1 B. 3 C. 4 D. 5
难度: 极难查看答案及解析