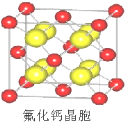
-
酸雨给人类带来了种种灾难,严重地威胁着地球生命生存的生态环境,下列有关减少或者防止酸雨形成的措施中可行的是
①将煤液化或气化,获得清洁燃料
②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中
③人工收集雷电作用所产生的氮的氧化物
④飞机、汽车等交通工具采用新能源,比如氢能
A.①②④ B.①②③ C.①②③④ D.①③④
难度: 简单查看答案及解析
-
在一无色溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu2+ ②Fe3+ ③ Cl-④ NO3-⑤S2- ⑥CO32- ⑦ NH4+ ⑧Mg2+⑨Al3+ ⑩AlO2-离子。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
A.③⑤⑥⑦⑩ B.①②⑤⑥⑧⑨
C.③④⑦⑧⑨ D.①②③⑤⑥⑩
难度: 中等查看答案及解析
-
NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是
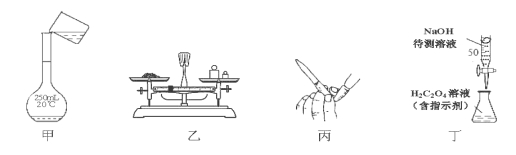
A.用图甲所示操作转移NaOH溶液到容量瓶中
B.用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体
C.用图丙所示操作排除碱式滴定管中的气泡
D.用图丁所示装置以NaOH待测液滴定H2C2O4溶液
难度: 中等查看答案及解析
-
某课外活动小组的同学从某地颗粒采集器中获得雾霾颗粒样品,然后用蒸馏水浸取。在探究雾霾颗粒可溶性成分的实验中,下列根据实验现象得出的结论不正确的是
A.向浸取液中滴入AgNO3溶液有白色沉淀产生,说明雾霾中可能含有Cl-
B.向浸取液中滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,说明雾霾中一定含SO42-
C.向浸取液中加入Cu和浓H2SO4,试管口有红棕色气体产生,说明雾霾中可能含有NO3-
D.向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有NH4+
难度: 中等查看答案及解析
-
从植物中分离出的活性化合物zeylastral的结构简式如图所示,下列说法不正确的是
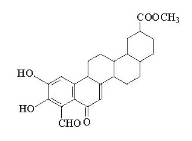
A.化合物 zeylastral可以发生水解反应
B.能与FeCl3溶液、银氨溶液发生反应
C.1mol zeylastral最多与5molH2发生反应
D.1mol zeylastral最多可与2molBr2发生反应
难度: 中等查看答案及解析
-
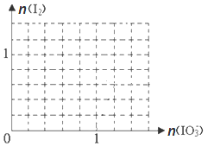
常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是
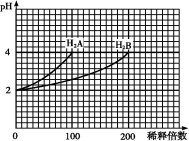
A.H2A为二元强酸
B.pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B)
D.Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+)
难度: 极难查看答案及解析
-
在2 L的密闭容器中进行如下反应:CO(g)+H2O(g)
CO2(g)+H2(g),有如下数据:
实验
温度/℃
起始量/mol
平衡量/mol
CO
H2O
CO2
H2
CO2
1
650
2.0
1.0
0
0
0.8
2
800
2.0
2.0
0
0
1.0
下列说法正确的是
A.正反应为放热反应
B.实验1中,CO的转化率为80%
C.650℃时,化学平衡常数K=
D.实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol
难度: 困难查看答案及解析