-
化学与人类生活、生产和社会可持续发展密切相关。下列说法正确的是( )
A.往自来水中加入明矾进行杀菌消毒
B.氮化硅陶瓷是一种新型的无机非金属材料
C.在食品袋中放入硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质
D.为提高农作物的产量和质量,应大量使用化肥和农药
难度: 简单查看答案及解析
-
下列关于化学用语的表示正确的是(
)
A.硫化钠的电子式:
B.质子数为35、中子数为45的溴原子:8035Br
C.乙酸的结构简式:C2H4O2
D.硫原子的结构示意图:
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.氧化钠、冰醋酸、硫酸钡都是电解质
B.电解、电离、电化学腐蚀均需在通电条件下才能发生
C.高氯酸、纯碱、氯化钾分别属于酸、碱、盐
D.福尔马林、漂白粉、胆矾均为混合物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A.78g 由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA
B.密闭容器中2mol
NO与1molO2充分反应,产物的分子数为2NA
C.5.6g铁与足量盐酸反应转移的电子数为0.3NA
D.标准状况下,2.24 LCCl4含有的共价键数为0.4NA
难度: 简单查看答案及解析
-
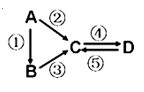
类比归纳是学习化学的重要方法,对如下类比的说法正确的是( )
A.CO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色
B.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应
C.CO2与SiO2化学性质相似,CO2与SiO2都能与水反应
D.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.某无色溶液:Na+、K+、MnO4-、CO32-
B.0.2 mol·L-1 NaNO3溶液中:H+、Fe2+ 、Cl-、SO42-
C.
mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
D.使甲基橙变红的溶
液:NH4+、CH3COO-、SO42-、Mg2+
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
B.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3
↓+H2O
C.向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
D.氯气溶于水:Cl2+H2O
2H++Cl-+ClO-
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,原子序数依次增大。Y原子的M电子层有1个电子,同周期的简单离子的半径中Z最小。W与X同主族,其最高化合价是最低负化合价绝对值的3倍。下列说法正确的是( )
A. 原子半径的大小:W > Z> Y
B. 简单气态氢化物的热稳定性: W > X
C. Y、Z、W最高价氧化物对应水化物能够两两发生反应
D. 简单离子的还原性:X> W
难度: 中等查看答案及解析
-
2015年8月12日天津爆炸事故中导致氰化钠泄漏,泄漏的氰化钠可以通过喷洒双氧水来处理,以
减轻环境污染,有关化学方程式为:NaCN+H2O2+H2O=NH3+NaHCO3,下列有关说法不正确的是 ( )
A.NaCN中碳元素化合价为+2价
B.在该反应中H2O2既作氧化剂又作还原剂
C.Na
CN中含有离子键和共价键
D.当有0.1mol NH3生成时,有0.2mol电子转移
难度: 中等查看答案及解析
-
氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3,CaH2+H2O→Ca(OH)2+H2.有关它们的叙述:
①离子半径:Na+>N3->H+;
②与水反应都是氧化还原反应;
③与水反应后的溶液都显碱性;
④与盐酸反应都只生成一种盐;
⑤两种化合物中的阴阳离子均具有相同的电子层结构。
其中有关说法正确的是( )
A.②③④⑤ B.②④ C.①③⑤ D.③
难度: 简单查看答案及解析
-
由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )

A.断键吸收能量之和大于成键释放能量之和
B.反应物总能量小于生成物总能量
C.N2O(g) +NO(g) =N2(g) +NO2(g)△H= -139kJ/mol
D.反应生成1 mol N2时转移4 mol电子
难度: 中等查看答案及解析
-
下列实验方案中,能达到实验目的的是( )
选项
实验目的
实验方案
A
证明氧化性:H2O2比Fe3+强
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
B
鉴别KBr溶液和KI溶液
分别加入新制氯水,再加入CCl4振荡、静置,观察
C
配制100 mL 1.0 mol·L-1 CuSO4溶液
将25 g CuSO4·5H2O溶于100 mL蒸馏水中
D
除去CuO中混有的Al2O3:
加入过量盐酸溶液后,过滤
难度: 中等查看答案及解析
-
下列
物质的转化在给定条件下能实现的是( )
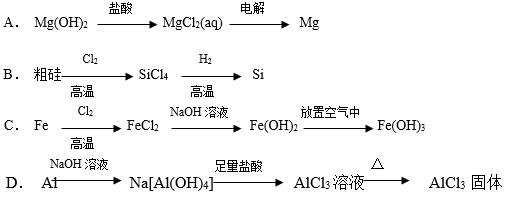
难度: 中等查看答案及解析
-
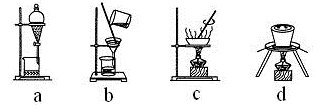
下列有关实验的选项正确的是( )
A.下列装置中X若为苯,可用于吸收NH3或HCl,并防止倒吸
B.加热烧杯,可以分离NaCl中NH4Cl
C.制备MgCl2晶体
D.记录滴定终点读数为12.20 mL
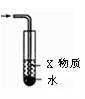
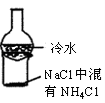
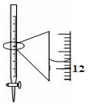
难度: 中等查看答案及解析
-
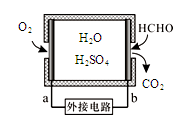
工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为2:1,以下说法不正确的是( )
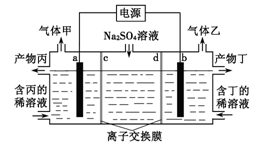
A.a极与电源的负极相连
B.离子交换膜d为阴离子交换膜
C.产物丙为硫酸溶液
D.a电极反应式:2H2O+2e-=H2↑+2OH-
难度: 中等查看答案及解析
-
实验研究发现,金属与硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉
的混合物与足量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL)与
产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
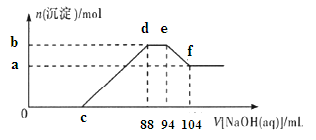
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.b点与a点的差值为0.05 mol
C.c点对应NaOH溶液的体积为40 mL
D.样品中铝粉和铁粉的物质的量之比为10:9
难度: 极难查看答案及解析