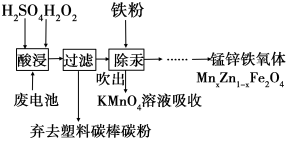
-
化学与生产、生活密切相关。下列说法错误的是
A.“硅胶”常用作袋装食品的干燥剂
B.氢氧化铝具有弱碱性,常用作胃酸中和剂
C.碳纤维,是一种新型无机非金属材料
D.工业上以氯气和澄清石灰水为原料制造漂白粉
难度: 简单查看答案及解析
-
将铁片放入下列溶液中,溶液质量增加,但没有气体放出的是
A.稀硫酸 B.CuSO4溶液 C.FeCl3溶液 D.稀硝酸
难度: 简单查看答案及解析
-
下列有关仪器的使用方法或实验操作正确的是
A.用分液漏斗和烧杯分离水和乙酸乙酯的混合物
B.用瓷坩埚熔融烧碱
C.用玻璃棒蘸少量待测物质的浓溶液做焰色反应
D.将pH试纸直接插入溶液中测量某溶液pH
难度: 简单查看答案及解析
-
下列有关氯元素及其化合物的表示正确的是
A.质子数为17、中子数为20的氯原子:
B.氯离子(Cl-)的结构示意图:

C.次氯酸分子的电子式:
D.氯乙烯分子的结构简式:H3C-CH2Cl
难度: 简单查看答案及解析
-
《新科学家》网站报道,科学家通过电解Fe2O3、SiO2、CaO的熔融液(1 600 ℃)制得了铁。若该方法用于工业上冶铁,与常规方法相比,下列说法错误的是
A.大幅度降低能耗
B.电解时铁在阴极上析出
C.降低温室气体的排放
D.生成等量的铁时,此方法与热还原法转移的电子数相同
难度: 中等查看答案及解析
-
粒子甲在溶液中的转化关系如下图所示,粒子甲不可能是

A.NH4 + B.Al(OH)3 C.S D.Al
难度: 中等查看答案及解析
-
下列关于元素周期表的说法中正确的是
A.同一主族元素的原子序数的差不可能为10
B.同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1
C.催化剂一般在金属与非金属的分界线处寻找
D.过渡元素全部是金属元素
难度: 简单查看答案及解析
-
用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=-10的溶液中能大量共存的离子是:
A.Ba2+、K+、Cl-、SO32-
B. Na+、SiO32-、AlO2—、SO42-
C.Na+ 、K+、HCO3-、S2-
D. K+ 、NH4+、Fe3+、 I一
难度: 中等查看答案及解析
-
一定条件下,等物质的量的下列物质分别与足量的浓盐酸反应,产生Cl2的物质的量最多的是
A.MnO2 B.KClO3 C.KMnO4 D.Ca(ClO)2
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+==Fe2++2Fe3++4H2O
B.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O ==HClO+ HSO3-
C.向MgSO4溶液中滴加Ba(OH)2溶液:Ba2+ + SO42- ==BaSO4↓
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:
Ba2+ + 2OH- + NH4+ + H+ + SO4 2- == BaSO4↓+ NH3·H2O + H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA
B.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA
C.1.8 g D2O中含有的质子数和电子数均为NA
D.0.1molNa完全被氧化生成Na2O2时,转移的电子数目为0.1NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有4个电子,Y是地壳中含量最高的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
A.X、Y、Z、W四种元素的最外层电子数之和为18
B.原子半径由大到小的顺序:W>Z>Y>X
C.单质的熔点:W>Z
D.简单气态氢化物的稳定性:X>Y>W
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
SO2通入溴水中
溶液褪色
SO2有漂白性
B
将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液
溶液变红
Fe(NO3)2样品已氧化变质
C
向饱和碳酸钠溶液中通入CO2
有晶体析出
溶解度: NaHCO3>Na2CO3
D
向盛有少量NaHCO3的试管中滴加草酸溶液
有气泡产生
酸性:草酸>碳酸
难度: 中等查看答案及解析
-
NaNO2是一种食品添加剂,它能致癌。酸性高锰酸钾溶液与亚硝酸钠的反应方程式是:MnO4-+ NO2- + H+→Mn2+ + NO3- + H2O。下列叙述中正确的是
A.NaNO2既具有氧化性又具有还原性
B.该反应中NO2-被还原
C.反应过程中溶液的pH变小
D.生成1molNaNO3需要消耗0.6molKMnO4
难度: 中等查看答案及解析
-
将0.4mol体积比为1∶1甲和乙两种混合气体同时通入50mL1mol·L-1的丙溶液中,无沉淀产生的是
序号
甲
乙
丙
A
Cl2
SO2
Ba(NO3) 2
B
HCl
CO2
石灰水
C
NH3
SO2
Ba(OH)2
D
NO2
SO2
BaCl2
难度: 中等查看答案及解析
-
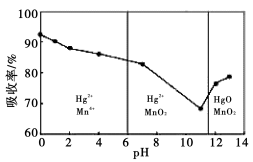
常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol·L-1 NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是

A.从反应开始至②点,发生反应的离子方程式为:Cl2 +H2O == ClO-+ 2H++ Cl-
B.③处表示氯气和NaOH溶液恰好完全反应
C.②点所表示的溶液中所存在的具有氧化性的含氯元素的微粒主要有:Cl2 、HClO、ClO-
D.从反应开始至②点可用pH试纸测定溶液的pH
难度: 困难查看答案及解析