-
碘是人体必需的微量元素,127I的中子数为74,则其原子序数为
A.201 B.127 C.74 D.53
难度: 简单查看答案及解析
-
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于Y的说法正确的是
A.Y在周期表中的位置是第4周期ⅢB族
B.属于非金属元素
C.Y和Y是两种不同的核素
D.核素Y的质子数与中子数之差为50
难度: 中等查看答案及解析
-
下列化学用语表达正确的是
A.溴化铵的电子式:
B.CO2的电子式:
C.HClO的结构式:H—Cl—O D.氮分子的结构式:N≡N
难度: 中等查看答案及解析
-
已知某元素R的气态氢化物的化学式为H2R,下列叙述中不正确的是
A.该元素的原子最外电子层上有6个电子
B.该元素的最高价氧化物的化学式为RO2
C.该元素一定是非金属元素
D.该元素最高价氧化物对应的水化物的化学式为H2RO4
难度: 中等查看答案及解析
-
下列分子中所有原子均满足最外层8电子结构的是
A.LiCl B.NCl3 C.PCl5 D.BF3
难度: 中等查看答案及解析
-
下列关于元素周期表的说法正确的是
A.元素周期表是按照元素相对原子质量大小排列而成的
B.元素周期表有7个横行,也是7个周期;有18个纵行,即18个族
C.凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8
D.凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多
难度: 中等查看答案及解析
-
无机化学命名委员会(国际组织)在1999年作出决定,把长式周期表原先的主副族序号取消,由左到右按原顺序编为18列,按这个规定,下列说法正确的是
A.第一列的元素都是金属元素
B.第三列所含的元素种类最多
C.第18列元素原子的最外层电子数均为8
D.只有第二列元素的最外层电子数为2
难度: 中等查看答案及解析
-
下列关于卤素的叙述不正确的是
A.随核电荷数递增,卤素单质熔沸点升高
B.随核电荷数递增,卤化氢的稳定性增强
C.随核电荷数递增,卤素离子的还原性增强
D.随核电荷数递增,卤素原子半径增大
难度: 中等查看答案及解析
-
下列各组元素的性质递变情况错误的是
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的金属性依次增强
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
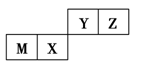
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的弱
D.Z位于元素周期表中第二周期、第ⅥA族
难度: 中等查看答案及解析
-
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.一个D2O分子所含的中子数为8
B.NH3的结构式为
C.HF、HCl、HBr、HI的熔沸点逐渐升高
D.热稳定性:H2S>HF
难度: 中等查看答案及解析
-
某元素最高正价与负价绝对值之差为4,该元素的离子与跟其核外电子排布相同的离子形成的化合物是
A. MgO B.K2S C.MgS D.NaF
难度: 简单查看答案及解析
-
下列各组顺序的排列不正确的是
A.离子半径:Na+>Mg2+>Al3+>F-
B.热稳定性:HCl>H2S>PH3
C.碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3
D.酸性强弱:H2SO4>H2CO3>H2SiO3
难度: 中等查看答案及解析
-
有X、Y、Z、W四种元素,它们的原子序数分别为6、10、11、17,下列判断错误的是
A.X、W能形成共价化合物 B.Z、W能形成离子化合物
C.Y分子中存在共价键 D.Y和Z不能形成化合物
难度: 中等查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm-,它们具有相同的电子层结构,若m>n,则下列叙述正确的是
① a-b=n-m
②元素的原子序数:a>b>c>d
③元素非金属性:Z>R
④最高价氧化物对应的水化物的碱性:X>Y
A.只有③ B.①②③④ C.①②③ D.②③
难度: 中等查看答案及解析
-
下列事实不能作为实验判断依据的是
A.钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱
B.在MgCl2 与AlCl3 溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱
C.硫酸和硅酸钠溶液反应产生白色沉淀,判断硫与硅的非金属活动性强弱
D.Br2 与I2 分别与足量的H2 反应,判断溴与碘的非金属活动性强弱
难度: 中等查看答案及解析
-
关于化学键的下列叙述中正确的是
A.离子化合物中不含共价键 B.共价化合物中可能含有离子键
C.离子化合物中只含离子键 D.共价化合物中不含离子键
难度: 中等查看答案及解析
-
已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w g R2-所含有电子的物质的量是
A. mol B.mol C.(m-n-2)mol D.(m-n+2)mol
难度: 中等查看答案及解析
-
2009年,曾报道合成分离了含高能量的正离子N
的化合物N5AsF6,下列叙述错误的是
A.N
共有34个核外电子 B.N
中氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1 D.化合物N5AsF6中F化合价为-1
难度: 中等查看答案及解析
-
短周期元素甲、乙、丙、丁、戊在元素周期表中的相对位置如图所示。下列说法正确的是
A.原子半径的大小顺序为:甲>乙>丙>戊
B.氢化物的稳定性:乙>丁;氢化物的沸点:丁>乙
C.元素甲与元素丙的最高正化合价之和的数值等于8
D.元素戊的氧化物对应的水化物的酸性一定比丁的强
难度: 中等查看答案及解析
-
如下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是
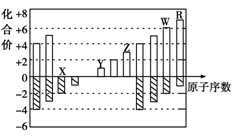
A.气态氢化物的稳定性:R>W
B.X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C.由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
M
R
Q
原子半径(×10-10 m)
1.86
0.99
1.43
1.60
0.75
0.74
主要
化合价
最高正价
+1
+7
+3
+2
+5
—
最低负价
—
-1
—
—
-3
-2
下列说法正确的是
A.X、Z、R的最高价氧化物的水化物之间可两两相互反应
B.元素X和Q形成的化合物中不可能含有共价键
C.X、Z、M的单质分别与水反应,Z最剧烈
D.Y的氢化物的水溶液可用于蚀刻玻璃
难度: 中等查看答案及解析
