-
化学与环境、材料、信息、能源关系密切,下列说法中不正确的是
A. 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜要求
B. “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
C. 氮的固定只有在高温、高压、有催化剂存在的条件下才能实现
D. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
难度: 中等查看答案及解析
-
有关Na2CO3和NaHCO3的性质,下列叙述错误的是
A. 相同温度下,等浓度的Na2CO3和NaHCO3溶液的碱性比较,前者更强
B. 常温时水溶性:Na2CO3>NaHCO3
C. 在酒精灯加热的条件下,前者不分解,后者分解
D. 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者无现象
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是
A. 在含有0.1 mol/L Ca2+的溶液中:Na+、K+、ClO-、Cl-
B. 在pH=12的溶液中:NH
、Na+、SO
、Cl-
C. 在c(H+)=0.1 mol/L的溶液中:K+、I-、Cl-、NO
D. 在澄清透明的无色溶液中:Na+、Cu2+、MnO
、NO
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法中正确的是
A. 常温、常压下,32 g O2和O3混合气体中含有2NA个原子
B. 常温下,5.6 g铁粉加入足量浓硝酸中反应,转移的电子数为0.3NA
C. 1 L 0.5 mol·L-1Na2CO3溶液中,阴阳离子总数为1.5NA
D. 16 g CH4与18 g NH
所含质子数相等
难度: 中等查看答案及解析
-
乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O
CH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是
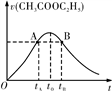
A. 图中A、B两点表示的c(CH3COOC2H5)相等
B. 反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
C. 图中t0时说明反应达到平衡状态
D. 图中tB时CH3COOC2H5的转化率等于tA时的转化率
难度: 中等查看答案及解析
-
下列说法正确的是
A. NaHSO4和NaHSO3都属于酸式盐,二者能够发生反应生成SO2
B. 95 ℃纯水的pH<7,说明加热可导致水呈酸性
C. 中和100 mL pH=1的醋酸和100 mL pH=1的盐酸所消耗的NaOH的物质的量相等
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
难度: 中等查看答案及解析
-
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A. 0.2 mol B. 0.4 mol
C. 0.6 mol D. 0.8 mol
难度: 困难查看答案及解析
-
下列离子方程式表达正确的是
A. 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B. 小苏打溶液呈碱性的原因:HCO
+H2O
H3O++CO
C. 溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D. 向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-===AlO2-+2BaSO4↓+NH3·H2O+2H2O
难度: 中等查看答案及解析
-
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。对下列反应的推断或解释正确的是
操作
可能的实验现象
解释
A
某溶液中加入硝酸酸化的氯化钡溶液
有白色沉淀生成
溶液中一定含有SO42-
B
将SO2通入Ba(NO3)2溶液中
有白色沉淀生成
SO2与Ba(NO3)2反应生成BaSO3
C
同温同压下用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性
碳酸钠溶液显碱性,硫酸钠溶液显中性
碳酸钠溶液发生了水解
D
向淀粉KI溶液中通入Cl2
溶液变蓝
Cl2与淀粉发生显色反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
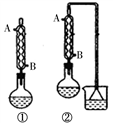
下列实验所用装置正确的是
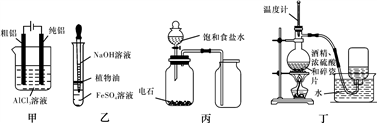
A. 用甲图装置电解精炼铝 B. 用乙图装置制备氢氧化亚铁
C. 用丙图装置制取乙炔 D. 用丁图装置制取乙烯
难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水
④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③ C.①④ D.②③
难度: 中等查看答案及解析
-
将一定量的氯气通入30 mL浓度为10 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A. 与NaOH反应的氯气一定为0.3 mol
B. n(Na+)∶n(Cl-)可能为7∶3
C. n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
D. 若反应中转移的电子为n mol,则0.15<n<0.25
难度: 困难查看答案及解析
-
某有机物M 7.4 g与足量氧气反应后,所得气体依次通过盛有浓H2SO4和碱石灰的装置,两装置分别增重9 g和17.6 g;同温同压下,M蒸汽的密度是H2的37倍,则能够与钠反应放出H2的M的同分异构体的数目(不考虑立体异构)
A.8 B.6 C.4 D.2
难度: 困难查看答案及解析
-
将11.2 g的MgCu混合物完全溶解于足量的硝酸中,收集反应产生的气体X(假定产生的气体全部逸出)。再向所得溶液中加入足量的NaOH溶液,产生21.4 g沉淀。气体X的成分可能是
A. 0.3 mol NO2和0.3 mol NO
B. 0.6 mol NO
C. 0.2 mol NO2和0.1 mol N2O4
D. 0.1 mol NO、0.2 mol NO2和0.05 mol N2O4
难度: 困难查看答案及解析
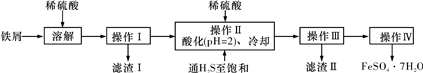
 )是应用广泛的原料及医药中间体,其合成路线如下所示:
)是应用广泛的原料及医药中间体,其合成路线如下所示: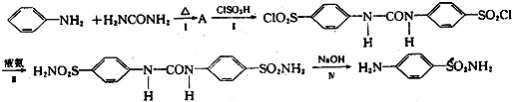
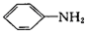 和H2NCONH2以2∶1(物质的量之比,下同)反应则得到有机物A,但如果以1∶1反应则可以得到有机物B。
和H2NCONH2以2∶1(物质的量之比,下同)反应则得到有机物A,但如果以1∶1反应则可以得到有机物B。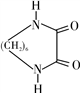 的过程。_______________
的过程。_______________ CH2=CH2
CH2=CH2