-
下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为电能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
难度: 简单查看答案及解析
-
下列各图中,表示正反应是吸热反应的是:( )
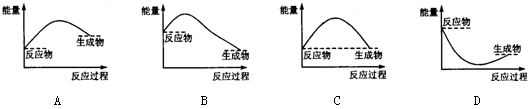
难度: 简单查看答案及解析
-
用食用白醋(醋酸浓度约1 mol/L)进行下列实验,能证明醋酸为弱电解质的是( )
A. 白醋中滴入石蕊试液呈红色 B. 白醋加入豆浆中有沉淀产生
C. 蛋壳浸泡在白醋中有气体放出 D. pH试纸显示白醋的pH为2~3
难度: 简单查看答案及解析
-
已知反应3A(g)+B(g)
C(s)+4D(g)+Q,右图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是:①增大B的浓度 ②升高反应温度 ③缩小反应容器的体积(加压) ④加入催化剂( )
A ①② B ①③ C ②③ D ③④
难度: 简单查看答案及解析
-
一定温度下,可逆反应A2(g)+B2(g)
2AB(g)达到平衡状态的标志是:( )
A.单位时间内生成 n mol A2,同时生成 n mol AB
B.体系内的总压不随时间变化
C.单位时间内生成2n mol AB的同时生成n mol B2
D.单位时间内生成 n mol A2的同时,生成n mol B2
难度: 简单查看答案及解析
-
下列离子方程式中,属于水解反应的是:( )
A.HCOOH+H2O
HCOO— + H3O+ B.CO2+H2O
HCO3— + H+
C.CO32— + H2O
HCO3— + OH— D.HS— + H2O
S2— + H3O+
难度: 简单查看答案及解析
-
将纯水加热至80℃,下列叙述正确的是( )
A. 水的离子积不变 B. 水的pH变小,呈酸性
C. 水的pH变大,呈中性 D. 水中的c(H+)=c(OH-)>1×10-7 mol/L
难度: 简单查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是:( )
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
难度: 简单查看答案及解析
-
常温下,下列离子能使纯水中的H+离子数目增加的是 ( )
A.S2- B.CO32- C.NH4+ D.Br-
难度: 简单查看答案及解析
-
下列水解化学方程式或水解离子方程式正确的( )
A.CH3COO— + H2O
CH3COOH + OH— B.NH4+ + H2O
NH4OH + H+
C.CH3COOH + NaOH
CH3COONa + H2O D.NaCl + H2O
NaOH + HCl
难度: 简单查看答案及解析
-
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为 ( )
A.c (CH3COO-)=c (Na+) B.c (OH-)>c (H+)
C.c (CH3COOH)>c (CH3COO-) D.c (CH3COOH)+c (CH3COO-)=0.01mol/L
难度: 简单查看答案及解析
-
根据下列热化学方程式( )
(1)C(s) + O2(g) = CO2(g) △H1=–393.5 kJ/mol
(2)H2(g) +
O2(g) =H2O(l) △H2=–285.8 kJ/mol
(3)CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3kJ/mol
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
A.△H=244.1kJ/mol B.△H=-488.3kJ/mol
C.△H=-996.6kJ/mol D.△H=996.6kJ/mol
难度: 简单查看答案及解析
-
在室温下,100ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH值减小,但又要使醋酸电离程度减少,应采取( )
A.加入少量CH3COONa固体 B.通入少量氯化氢气体
C.提高温度 D.加入少量纯醋酸
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.95 ℃纯水的pH<7,说明加热可导致水呈酸性
B.pH = 3的醋酸溶液,稀释至10倍后pH<4
C.0.2 mol·L-1的盐酸,与等体积水混合后pH = 2
D.pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7
难度: 简单查看答案及解析
-
下列有关AgCl沉淀的溶解平衡的说法正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率不相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解平衡不移动。
难度: 简单查看答案及解析
-
将一定量的碳酸钙放入水中,对此有关的叙述正确的是( )
A.碳酸钙不溶于水,碳酸钙固体质量不会改变
B.最终会得到碳酸钙的极稀的饱和溶液
C.因为Ca2++CO32-===CaCO3↓很容易发生,不存在CaCO3===Ca2++CO32-的反应
D.因为碳酸钙难溶于水,所以改变外界条件也不会改变碳酸钙的溶解性
难度: 简单查看答案及解析
-
当固体AgCl放在较浓的KI溶液中振荡时,部分AgCl转化为AgI,其原因是.( )
A.AgI比AgCl稳定 B.氯的非金属性比碘强
C.I-的还原性比Cl-强 D.AgI的溶解度比AgCl小
难度: 简单查看答案及解析
-
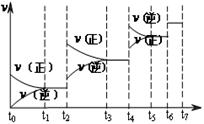
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g)
H2(g)+I2(g); △H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )。
难度: 简单查看答案及解析