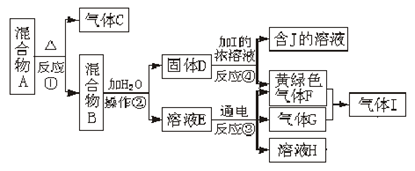
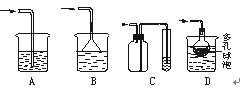
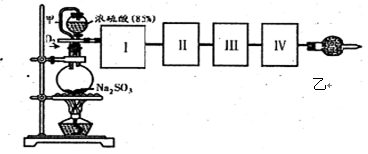
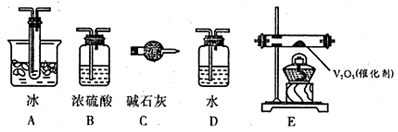
-
化学与生产、生活、社会密切相关,下列有关说法不正确的是( )
A.多用电子邮件、QQ等即时通讯工具,少用传真打印机,属于“低碳生活”方式
B.我国神七宇航员所穿航天服主要成分是由碳化硅陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
C.SO2具有漂白性且成本较低,所以可大量用于食品工业的脱色
D.日本福岛核电站爆炸时释放的2种放射性同位素131 53I与137 55Cs的中子数不等
难度: 中等查看答案及解析
-
7.设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.18gD2O中含的质子数为10NA
B.标准状况下22.4LSO3的分子数为NA
C.31g 白磷含有的共价键数为6NA
D. 电解CuCl2溶液时,若有NA个电子通过,则阴极增重32g
难度: 中等查看答案及解析
-
8.在一种无色溶液中,可能存在Na+、Ca2+、Fe3+、Br -、CO32-、SO42-、Cl-离子中的几种。
某学生进行了下列实验:(1)取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;(2)一份加AgNO3溶液,有白色沉淀产生;(3)另一份加BaCl2溶液,有白色沉淀产生。该溶液中一定大量存在的离子组是( )
A.Na+、Fe3+、SO42- B.CO32-、Cl-、SO42-
C.Ca2+、Br-、SO42- D.Na+、SO42-、CO32-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.红热的铜丝在Cl2中燃烧后生成蓝色的CuCl2
B.工业上将NH3与CO2在高温高压下制成[CO(NH2)2] 是氮的固定过程
C.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以使SO3吸收完全
D.工业制取单质硅时会产生大量导致“温室效应”的气体
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A.向CaCl2溶液中通入少量CO2: Ca2+ + CO2 + H2O = CaCO3↓+ 2H+
B.FeBr2溶液与等物质的量的Cl2反应:2Fe2+ +2Br - +2Cl2=2Fe3+ +4Cl-+Br2
C.Fe3O4与稀硝酸反应:2Fe3O4 +18H+=6Fe3+ +H2↑+8H2O
D.向次氯酸钙溶液通入少量SO2:Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓ + 2HClO
难度: 中等查看答案及解析
-
根据下列实验现象,所得结论正确的是( )
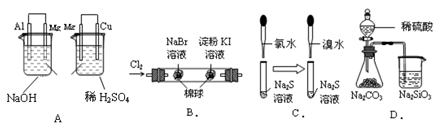
实验
实验现象
结论
A.
左烧杯中镁表面有气泡,右边烧杯中铜表面有气泡
活动性:Al>Mg>Cu
B.
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C.
左边溶液产生黄色沉淀,右边溶液产生黄色沉淀
氧化性:Cl2>Br2>S
D.
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:S>C>Si
难度: 中等查看答案及解析
-
已知晶体硅的燃烧热为989KJ/mol,且断裂1molSi-Si、Si-O需吸收的能量分别为176KJ, 460KJ,则1molO=O断裂时吸收的能量为( )
A .499KJ B .2477 KJ C. 245 KJ D.1557 KJ
难度: 中等查看答案及解析
-
将16. 0g铜与100 mL一定浓度硝酸反应,铜完全溶解产生NO和NO2混合气体在标准状况下体积为11.2 L。待产生的气体全部释放后,向溶液中加入100mL、bmol / L NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度一定为( )
A. 1.0 mol / L B.(b+5)mol / L C.10mol / L D.无法计算
难度: 中等查看答案及解析