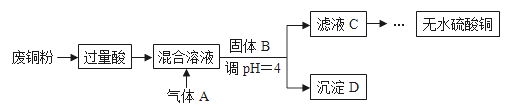
-
下列过程需要吸收热量的是
A.汽油燃烧 B.铝热反应 C.液氨汽化 D.酸碱中和
难度: 简单查看答案及解析
-
下列说法不正确的是
A.Cl2能使湿润的有色布条褪色,所以Cl2具有漂白性
B.红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl3
C.利用溴单质的氧化性可以把碘离子转化为碘单质
D.实验室常用NaOH溶液吸收多余的Cl2以避免污染
难度: 中等查看答案及解析
-
下列关于硫酸铜溶液和氢氧化铁胶体的说法中,正确的是
A.前者是混合物,后者是纯净物 B.两者都具有丁达尔效应
C.分散质的粒子直径均在1~100nm之间 D.前者可用于杀菌,后者可用于净水
难度: 简单查看答案及解析
-
实验室有两瓶失去标签的溶液,其中一瓶是K2SO4溶液,另一瓶是NaOH溶液。鉴别时,下列选用的试纸或试剂不正确的是
A.pH试纸 B.紫色石蕊试液 C.Na2CO3固体 D.CuCl2溶液
难度: 中等查看答案及解析
-
Na2CO3+CO2+H2O=2NaHCO3的反应类型是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
难度: 中等查看答案及解析
-
下列仪器及其名称不正确的是

难度: 简单查看答案及解析
-
下列物质中属于盐的是
A.MgO B.H2SO4 C.NaOH D.KNO3[
难度: 简单查看答案及解析
-
下列实验操作、现象和结论均正确的是

难度: 中等查看答案及解析
-
下列操作或装置能达到实验目的的是

难度: 中等查看答案及解析
-
化学与生活和工农业生产密切相关,下列说法不正确的是
A.Fe2O3俗称铁红,常用作红色油漆和涂料
B.二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等,还可用于杀菌消毒
C.废旧钢材焊接前,分别用饱和Na2CO3,NH4Cl溶液处理焊点
D.聚丙烯酸钠树脂广泛应用于植物移栽及制作尿不湿
难度: 中等查看答案及解析
-
下列事实不能用元素周期律解释的只有
A.碱性:KOH>NaOH B.相对原子质量:Ar>K
C.酸性:HClO4>H2SO4 D.元素的金属性:Mg>Al
难度: 中等查看答案及解析
-
在通常条件下,下列各组物质的性质排列正确的是
A.熔点:Na> MgO>SiO2 B.水溶性:SO2>H2S> HCl
C.热稳定性:HF>H2O>NH3 D.沸点:HF> HCl >HBr
难度: 中等查看答案及解析
-
“玉兔”号月球车用
Pu作为热源材料.下列关于
Pu的说法正确的是
A.
Pu与
U互为同位素 B.
Pu与
Pu互为同素异形体
C.
Pu与
U化学性质完全相同 D.
Pu与
Pu最外层电子数相同
难度: 中等查看答案及解析
-
第116号元素Lv的名称为鉝.关于
Lv的叙述错误的是
A.原子序数为116 B.中子数为177 C.核外电子数为116 D.原子质量为293
难度: 简单查看答案及解析
-
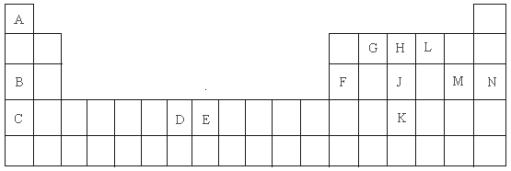
短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21,下列说法正确的是( )
A.气态氢化物的稳定性:X>Y
B.最高价氧化物对应的水化物的酸性:Y>X>W
C.Q可分别与X、Y、Z、W形成化学键类型相同的化合物
D.Y的简单离子半径小于Z的简单离子半径
难度: 中等查看答案及解析
-
X、Y、Z、W、R属于短周期元素。已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2︰1。下列叙述错误的是( )
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R> W> Z
D.Y分别与Z、W、R以两种元素组成的常见化合物有5种
难度: 中等查看答案及解析
-
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是( )
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W含氧酸的酸性一定比Z的含氧酸的酸性强
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,第三周期中Z元素的简单离子半径最小,下列说法不正确的是( )
X
Y
Z
W
Q
A.Y元素气态氢化物的稳定性高于X元素的气态氢化物
B.形成的简单离子半径W>Q>Z>X
C.最高价氧化物对应的水化物酸性最强的是Q
D.X的最高价氧化物对应的水化物和X的氢化物形成的化合物含有离子键、共价键
难度: 中等查看答案及解析
-
a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是( )
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与题中其他元素生成的化合物都是离子化合物
D.c、d形成的气态氢化物的还原性:d>c
难度: 中等查看答案及解析
-
某同学设计如下元素周期表,以下说法正确的是( )

A.X、Y、Z元素分别为N、P、O
B.白格中都是主族元素,灰格中都是副族元素
C.原子半径:Z>X>Y
D.X、Y、Z的气态氢化物中最稳定的是Y的氢化物
难度: 中等查看答案及解析
-
如图所示,△H1=﹣393.5kJ•mol﹣1,△H2=﹣395.4kJ•mol﹣1,下列说法或表示式正确的是
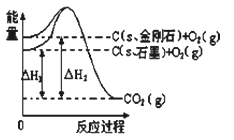
A.C(s、石墨)═C(s、金刚石)△H=﹣1.9 kJ•mol﹣1
B.石墨和金刚石的转化是物理变化
C.石墨的稳定性强于金刚石
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 中等查看答案及解析
-
下列图示变化为吸热反应的是( )

难度: 简单查看答案及解析
-
把太阳光变成激光可用于分解海水制氢气:2H2O
2H2↑+O2↑。下列说法正确的是( )
A.水的分解反应是放热反应 B.氢气是一次能源
C.使用氢气作燃料将会增加温室效应 D.在这一反应中,光能转化为化学能
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应 B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的C与H2O反应 D.甲烷在O2中的燃烧反应
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A.化学反应除了生成新的物质外,还伴随着能量的变化
B.化学反应中的能量变化与反应物的总能量和生成物的总能量的相对大小无关
C.放热的化学反应不需要加热就能发生
D.吸热反应不加热就不会发生
难度: 中等查看答案及解析
-
我国成功研制出新型“海水电池”。电池反应为4Al +3O2 +6H2O=4Al(OH)3。下列关于该电池的说法不正确的是

A.铝片作负极
B.海水作为电解质溶液
C.电池工作时O2得到电子
D.电池工作时实现了电能向化学能的转化
难度: 简单查看答案及解析
-
工业制备硫酸过程中存在如下反应:2SO2 + O2
2SO3,下列关于该反应的说法正确的是
A.增大O2的浓度能加快反应速率 B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率 D.一定条件下SO2能100%转化为SO3
难度: 中等查看答案及解析
-
右图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B.如果将锌片换成铁片,电路中的电流方向将改变
C.其能量转化的形式主要是“化学能→电能→光能”
D.如果将稀硫酸换成柠檬汁,LED灯将不会发光
难度: 中等查看答案及解析
-
下列反应过程中的能量变化与右图一致的是( )
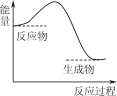
A.2Al+Fe2O3
2Fe+Al2O3
B.CaCO3
CaO+CO2↑
C.C+H2O
CO+H2
D.C+CO2
2CO
难度: 简单查看答案及解析