-
化学与社会、生产、生活密切相关。下列说法不正确的是
A.硅胶可用作食品干燥剂 B.乙醇可作消毒剂
C.氢氧化铝可作胃酸中和剂 D.二氧化碳可作钠着火的灭火剂
难度: 中等查看答案及解析
-
下列不是用来确定有机物结构或官能团的是
A.红外光谱 B.核磁共振氢谱 C.质谱 D.银镜反应
难度: 简单查看答案及解析
-
分子式为C5H10O并能与新制的Cu(OH)2浊液反应的有机物有(不含立体异构)
A.3种 B.4种 C.6种 D.8种
难度: 中等查看答案及解析
-
某有机化合物,只含碳、氢、氧三种元素中的两种或三种,相对分子质量为74,完全燃烧时产生等物质的量的CO2和H2O。它的分子式可能为
A.C4H10O B.C4H4O2 C.C3H6O2 D.C4H8O2
难度: 中等查看答案及解析
-
某有机化合物的结构简式如右图,对该有机化合物说法错误的是
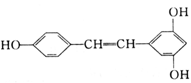
A.是苯酚的同系物 B.可发生加成、氧化、取代等反应
C.所有原子可能共平面 D.分子式为C14H12O3
难度: 困难查看答案及解析
-
能用酸性高锰酸钾溶液鉴别的一组物质是
A.己烷和苯 B.乙烯和乙炔 C.乙醇和乙醛 D.甲苯和苯
难度: 中等查看答案及解析
-
室温下,下列溶液等体积混合后pH一定大于7的是
A.pH=3的醋酸与pH=11的氢氧化钾 B.0.1mol/L的盐酸与0.1mol/L的氨水
C.0.001mol/L的盐酸与pH=11的氨水 D.pH=3的盐酸与0.001mol/L的氨水
难度: 困难查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是
A.46g乙醇中存在的共价键总数为7NA
B.1mol-OH和1molOH-所含电子数均为9NA
C.密闭容器中1molNO与1molO2充分反应,产物的原子数为4NA
D.标准状况下,22.4L庚烷完全燃烧生成二氧化碳分子数为8NA
难度: 困难查看答案及解析
-
100℃时,水的离子积为1×10-12,该温度下某溶液中的c(H+)为10-7mol.L-1,则该溶液
A.呈碱性 B.呈酸性 C.呈中性 D.无法判断
难度: 中等查看答案及解析
-
下列指定的比值为2:1的是
A.0.2mol/L和0.1mol/L的氨水中c(OH-)之比
B.H2S溶液中c(H+)与c(S2-)之比
C.Na2S溶液中c(Na+)与c(S2-)之比
D.Na2O2晶体中阳离子与阴离子个数之比
难度: 中等查看答案及解析
-
烯烃在一定条件下发生氧化反应时碳碳双键发生断裂:
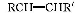
RCHO+R'CHO,在该条件下,下列烯烃分别经过上述条件氧化后产物可以生成甲醛的是
A.
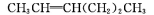
B.
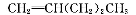
C.
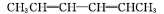
D.
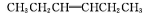
难度: 中等查看答案及解析
-
下列除去少量杂质(括号内为杂质),所选试剂和方法都正确的是
A.乙烷(乙烯):催化剂和H2,加热
B.苯(苯酚):氢氧化钠溶液,分液
C.CO2(SO2):饱和碳酸钠溶液,洗气
D.溴苯(溴):苯和铁粉,过滤
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式的是
A.AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
B.CO2通入苯酚钠溶液:2C6H5O-+H2O+CO2→2C6H5OH+CO32-
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+
2Fe(OH)3+3Mg2+
难度: 中等查看答案及解析
-
蓄电池在放电和充电时分别起原电池和电解池的作用,某电池分别在放电和充电时发生的反应:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列对该电池的判断错误的是
A.放电时,Fe是负极,NiO2是正极
B.充电时阴极上的电极反应式为:Fe(OH)2+2e-=Fe+2OH-
C.放电时电解质溶液中的阴离子向正极方向移动
D.蓄电池的电极必须浸入碱性电解质溶液中
难度: 困难查看答案及解析
-
右图分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是
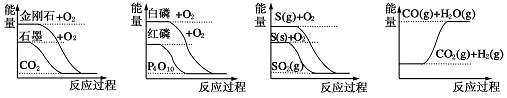
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.S(g)+O2(g)=SO2(g) ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
难度: 中等查看答案及解析
-
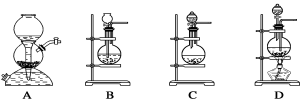
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
选项
①中物质
②中物质
预测②中的现象
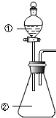
A
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C
HF溶液
SiO2
始终不溶解
D
草酸溶液
高锰酸钾酸性溶液
溶液逐渐褪色
难度: 中等查看答案及解析
-
Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑。下列说法正确的是

A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.该反应也可设计为原电池
难度: 简单查看答案及解析
-
利用右图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
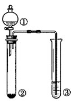
A
稀盐酸
MnO2
石蕊溶液
石蕊溶液先变红后褪色
B
浓硫酸
蔗糖
品红
浓硫酸有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
生成BaSO3白色沉淀
D
醋酸
Na2CO3
苯酚钠溶液
酸性:醋酸>碳酸>苯酚
难度: 困难查看答案及解析
-
常温下,下列溶液的离子浓度关系式正确的是
A.浓度相同的Na2CO3和NaHCO3混合溶液中,c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B.0.1mol/L①醋酸②氯化铵③硫酸溶液中,水电离产生的氢离子浓度大小顺序是②>①>③
C.0.1mol/L的NaHCO3溶液中C(Na+)+c(H+)=c(OH-)+c(HCO3-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):③>②>①
难度: 困难查看答案及解析
-
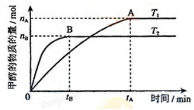
一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+B(g)
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确的是
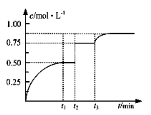
A.反应方程式中的x=1
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量物质D
D.t1~t3间该反应的平衡常数均为4
难度: 困难查看答案及解析