-
下列说法存在科学性错误的是( )
A.日本福岛核电站爆炸时释放的2种放射性同位素131I与137Cs的中子数相等
B.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去
C.用丁达尔现象可以区分食盐水和淀粉溶液
D.Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂难度: 中等查看答案及解析
-
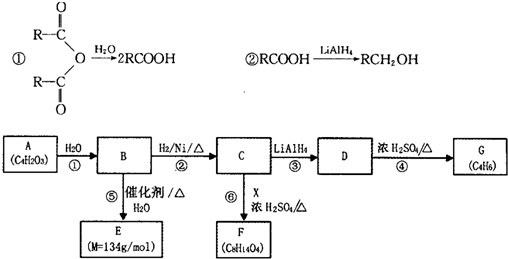
下列有关的说法中,正确的一组是( )
①蔗糖和麦芽糖的分子式都可用C12H22O11表示,它们互为同分异构体
②聚乙烯、聚氯乙烯、纤维素都属于合成高分子材料
③乙醇反应生成乙醛;乙醇反应生成乙烯两者反应类型相同
④除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏;
⑤分馏、蒸馏、裂化、水解都有新物质生成
⑥若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓硫酸作用下发生反应,一段时间后,分子中含有18O的物质有3种.
A.①③④
B.①②③④
C.①④⑥
D.①②⑤⑥难度: 中等查看答案及解析
-
下列实验操作正确的是( )
①用带橡皮塞的棕色试剂瓶存放浓硫酸;②将0.1mol/L的NaOH溶液与0.5mol/L的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基;③实验室制硝基苯要把温度计插在烧杯热水的中部;④可用FeCl3溶液除去试管内难以刷去的铜迹;⑤欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较;⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出;⑦蒸馏时,应使温度计水银球上缘与蒸馏烧瓶支管口下缘相平.
A.①④
B.③④⑥⑦
C.①③
D.②④⑤难度: 中等查看答案及解析
-
常温下,将amol/L的MOH(可溶性弱碱)与bmol/L的盐酸等体积混合,已知相同条件下MOH的电离程度大于M+的水解程度,则下列有关推论不正确的是( )
A.若混合后溶液的PH=7,则C(M+)=c(Cl-)
B.若a=2b,则C(M+)>c(Cl-)>c(MOH)>c(OH-)>c(H+)
C.若b=2a,则C(Cl-)>c(M+)>c(H+)>c(OH-)
D.若混合后溶液满足c(H+)=C(OH-)+c(MOH),则可推出a=b难度: 中等查看答案及解析
-
MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
下列说法不正确的是( )
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
(2)除去反应混合物中的不溶物
(3)电解混合液MnSO4+ZnSO4+2H2MnO2+Zn+2H2SO4.
A.步骤(1)中MnO2和H2SO4都是氧化剂
B.步骤(1)中每析出12.8gS沉淀共转移0.8mol电子
C.步骤(3)中电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用难度: 中等查看答案及解析
-
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是:A(g)+xB(g)⇌2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示.下列说法中正确是( )
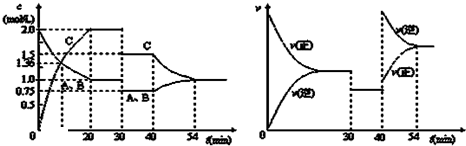
A.在一定条件下,当 v(正)A:v(逆)C=1:2时的状态即为化学平衡状态
B.20min时A的反应速率为0.5mol/
C.反应方程式中的x=1,正反应为吸热反应
D.30min时降低温度,40min时升高温度难度: 中等查看答案及解析
-
amol FeO与bmol Cu2S投入到Cmol/L的硝酸中恰好完全反应,生成NO共消耗硝酸VL,所得澄清溶液成分可看作为Fe(NO3)3、Cu(NO3)2、H2SO4的混合液,则反应中未被还原的硝酸不可能为( )
A.(189a+252b)g
B.
C.(3a+2b)×63g
D.(3a+4b)mol难度: 中等查看答案及解析