-
实验室用锌与稀硫酸反应制取H2,欲使产生H2的速率加快,下列措施可行的是
A.加水稀释 B.加少量NaOH溶液
C.降低温度 D.锌片改为锌粒
难度: 简单查看答案及解析
-
某有机化合物的结构简式如图所示,下列说法正确的是( )
A.不能发生银镜发应
B.1mol 该物质最多可与2molBr2反应
C.1mol 该物质最多可与4mol NaOH反应
D.与NaHCO3、Na2CO3均能发生反应
难度: 简单查看答案及解析
-
某元素最高价氧化物对应的水化物的化学式为H2XO3,该元素的气态氢化物的化学式是( )
A. XH4 B. H2X C. XH3 D. HX
难度: 简单查看答案及解析
-
①在点燃H2、CO、CH4等易燃气体前,必须检验气体的纯度
②在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中并不断用玻璃棒搅拌
③浓碱液对皮肤有腐蚀性,如果不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸溶液
④给试管中的液体加热时,液体体积应不超过试管容积的三分之一
⑤点燃添满酒精的酒精灯
⑥给试管中的液体加热时,试管口不能对着自己或他人
A. ⑤⑥ B. ①②③ C. ①②③④⑥ D. 全部
难度: 中等查看答案及解析
-
8月12日天津港发生爆炸事故原因猜测认为硝化棉或者硫化钠自燃是可能的点火源,因此化学药品的安全存放是非常重要的。下列有关化学药品的存放说法不正确的是
A.液溴易挥发,应用水液封并放在冷暗处保存
B.金属钠遇到氧气立即反应,应保存在煤油中或者液体石蜡里
C.硝酸见光易分解,应用棕色广口试剂瓶保存
D.碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存
难度: 中等查看答案及解析
-
根据图中包含的信息分析,下列叙述正确的是(
)

A.氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量
B.436kJ/mol是指断开1molH 2 中的H-H键需要放出436kJ的能量
C.431kJ/mol是指生成2molHCl中的H-Cl键需要放出431kJ的能量
D.氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量
难度: 简单查看答案及解析
-
铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间
后,发现铜粉质量减少,溶液呈蓝色,同时有气体逸出,该盐可能是( )
A.FeC13 B.Na2CO3 C.KNO3
D.FeSO4
难度: 简单查看答案及解析
-
将5mol·L-1 盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是
A.0.05mol/L B.0.25mol/L C.0.1mol/L D.0.5mol/L
难度: 简单查看答案及解析
-
下图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是
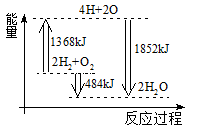
A. 拆开2molH2 (g)和1 molO2(g)中的化学键成为H、O原子,共放出1368 kJ能量
B. 由H、O原子形成2 molH2O(g),共吸收1852 kJ能量
C. 2 molH2 (g)和1 molO2 (g)反应生成2 molH2O(1),共吸收484 kJ能量
D. 2 molH2 (g)和1 molO2(g)反应生成2 moIH2O(g),共放出484 kJ能量
难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的是
A.常温下,在NH4Cl溶液中离子浓度大小顺序为c(Cl—)>c(NH4+)>c(H+) > c(OH—)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小
难度: 中等查看答案及解析
-
下列关于合金的说法正确的是
①合金至少含两种金属
②合金中元素以化合物形式存在
③合金的熔点比组成成分低
④合金一定是混合物
⑤铁锈是一种铁合金
A.①② B.②③⑤ C.③④ D.③
难度: 简单查看答案及解析
-
实验式相同,既不是同系物,又不是同分异构体的是( )
A.1-辛烯和3-甲基-1-丁烯 B.苯和乙炔
C.1
-氯丙烷和2-氯丙烷 D.甲苯和乙苯
难度: 简单查看答案及解析
-
以下关于混合物分离提纯操作或原理说法正确的是( )
A.实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法
B.用CCl4萃取碘水的实验中,振荡静置后,上层为紫红色溶液
C.利用植物油的密度比水小的原理,可用分液的方法分离这两种液体混合物
D.蒸馏时,温度计的水银球应充分接触溶液
难度: 简单查看答案及解析
-
下列反应中属于取代反应的是
A. 乙烯使酸性高锰酸钾溶液褪色
B. 乙烯与溴的四氯化碳溶液反应
C. 苯与浓硝酸和浓硫酸的混合液加热反应
D. 在苯中滴入溴水,溴水层变无色
难度: 简单查看答案及解析
-
常温下,Ksp(CaSO4)=9×10-6,常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是

A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp等于c点对应的Ksp
C.b点将有沉淀生成,
平衡后溶液中c(SO42-)一定不等于3×10-3mol•L-1
D.向d点溶液中加入适量CaCl2固体可以变到c点
难度: 困难查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
选项
叙述Ⅰ
叙述Ⅱ
A
NaCl是离子化合物
NaCl固体可导电
B
原电池可将化学能转化为电能
原电池需外接电源才能工作
C
1-己醇的沸点比己烷的沸点高89℃
1-己醇和己烷可通过蒸馏初步分离
D
乙二酸可与KMnO4
溶液发生反应
乙二酸具有酸性
难度: 简单查看答案及解析
-
已知2H→H2放出437.6 kJ的热量,下列说法正确的是( )
A.氢气分子内每个氢原子都达到了8电子稳定结构
B.1 mol H2的能量比2 mol H的能量低
C.1 mol H2离解成2 mol H要放出437.6 kJ热量
D.氢原子不如氢分子活泼
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH
D.镀层破损后,镀锌铁板比镀锡铁板更易腐蚀
难度: 中等查看答案及解析
-
下列实验方案不合理的是( )
A.除去乙烷中含有的乙烯:将气体通入溴水中,洗气
B.检验蔗糖是否水【解析】
取1mL 20%的蔗糖溶液,加3~5滴稀硫酸。水浴加热5min后取少量溶液,加氢氧化钠溶液调溶液pH至碱性,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象。C.除去乙酸乙酯中的乙酸:加入浓硫酸和乙醇,加热
D.鉴别己烯和苯:将溴的四氯化碳溶液分别滴加到少量己烯和苯
中
难度: 中等查看答案及解析
-
一定条件下反应:R2O7n-+3S2-+14H+=2R3++3S+7H2O。则R2O7n-中R的化合价是
A.+2
B.+3 C.+4 D.+6
难度: 简单查看答案及解析
-
下列说法不正确的是

A.乙烯与水反应制乙醇、乙醇与氧气反应制乙醛都属于加成反应
B.右图为阿司匹林的球棍模型,其分子式是C9H8O4
C.CH≡CH通过加聚反应可以得到结构片段为“…-CH=CH-CH=CH-…”的高分子化合物
D.往蛋白质溶液中加入饱和(NH4)2SO4溶液、CuSO4溶液都能产生沉淀,其原理不相同
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.2mol钠与过量盐酸反应生成NA个H2分子
B.金属钠加到冷水中,反应的离子方程式是:Na+2H2O===Na++OH-+H2↑
C.1molNa2O2与足量的水反应,转移电子数为2NA个
D.为测定熔融NaOH的导电性,可在瓷坩埚中熔化NaOH固体后进行测量
难度: 简单查看答案及解析
-
已知反应:HCl + NH3 = NH4Cl(固体)如下图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度。下列说法正确的是( )
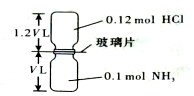
A.反应后瓶内压强是反应前的1/10 B.装置中氢元素的总质量为0.42 g
C.生成物的分子数目为0.1 NA D.反应结束后,两个集气瓶很容易分开
难度: 中等查看答案及解析
-
邻甲基苯甲酸有多种同分异构体,其中属于酯类且分子结构中有—CH3和苯环的同分异构体有
A. 6种 B. 5种 C. 4种 D. 3种
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
B.0.
1 mol/L NH4Cl溶液中Cl-离子数目为0.1 NA
C.反应3H2(g)+N2(g)
2NH3(g) ΔH=-92 kJ/mol,放出热量9.2 kJ时,转移电子0.6 NA
D.0.1 mol H2O2分子中含极性共价键数目为0.3 NA
难度: 中等查看答案及解析
