-
在温度和压强不变的条件下,当氧气的物质的量发生改变时,下列物理量一定不改变的是( )
A. 质量、摩尔质量 B. 体积、摩尔质量
C. 分子数、电子数 D. 密度、摩尔体积
-
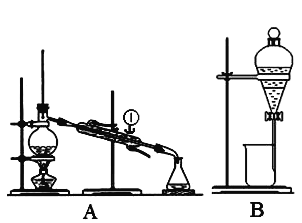
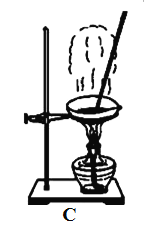
下列实验处理过程不正确的是( )

A. A B. B C. C D. D
-
下列各组气体或溶液用括号内试剂加以鉴别,其中不合理的是( )
A. 二氧化碳、氮气(澄清石灰水)
B. 氯化钠溶液、碳酸钠溶液(稀盐酸)
C. 硫酸钾溶液、碳酸钾溶液(氯化钡溶液)
D. 盐酸、硝酸溶液(硝酸银溶液)
-
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是( )
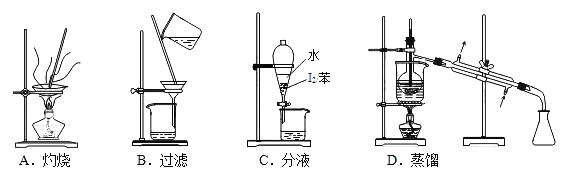
A. A B. B C. C D. D
-
己知乙酸异戊酯是难溶于水且密度比水小的液体。在洗涤、分液操作中,应充分振荡,然后静置,待分层后的操作是 ( )
A. 直接将乙酸异戊酯从分液漏斗的上口倒出
B. 直接将乙酸异戊酯从分液漏斗的下口放出
C. 先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D. 先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
-
对下列实验过程的评价,正确的是
A.某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
B.验证烧碱溶液中是否含有Cl﹣,先加稀硝酸除去OH﹣,再加入AgNO3溶液,有白色沉淀,证明含Cl﹣
C.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
D.某溶液中先滴加少量BaCl2溶液,再滴加足量稀盐酸,生成白色沉淀,证明该溶液一定含有SO42﹣
-
下列说法中正确的是
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含阿伏加德罗常数个氮分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
-
两份质量相同的CH4和NH3比较,下列结论错误的是( )
A.分子个数比为17:16
B.同温同压下两种气体的体积之比是17:16
C.氢原子个数比为17:12
D.原子个数比为17:16
-
某混合溶液中所含离子的浓度如下表,则M离子可能为( )
| 所含离子 | Cl- | SO42- | H+ | M |
| 浓度 /(mol·L-1) | 2 | 1 | 2 | 1 |
A. Na+ B. Ba2+ C. NO3- D. Mg2+
-
2013年4月20日在四川省雅安市芦山县发生7.0级地震,卫生防疫人员要紧急配制0.01 mol/L的KMnO4 消毒液,下列操作导致所配溶液浓度偏高的是( )
A. 所取的KMnO4样品受潮 B. 溶解搅拌时有液体溅出
C. 定容时俯视容量瓶刻度线 D. 摇匀后见液面低于刻度线,再加水至刻度线
-
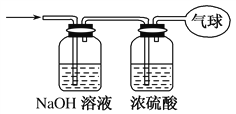
如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )

A. O3、N2 B. CH4、NH3 C. N2、O2 D. CO、CO2
-
设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A. 标准状况下,22.4 L由NH3和CH4组成的混合气体,所含分子数为NA
B. 常温常压下,28 g CO中所含碳原子数为NA
C. 1 L 0.5 mol·L-1 MgCl2溶液中,含有Cl-的个数为NA
D. NA个氯气分子的体积为22.4 L
-
某校化学兴趣小组在实验中发现一瓶溶液,标签上标有“CaCl2 0.1 mol·L-1”的字样,下面是该小组成员对溶液的叙述,正确的是( )
A.配制1 L该溶液,可将0.1 mol CaCl2溶于1 L水中
B.Ca2+和Cl-的物质的量浓度都是0.1 mol·L-1
C.从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05 mol·L-1
D.将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.1 mol·L-1
-
已知A、B都为短周期元素,且甲、乙、丙常温下都为气体(如图所示)。2 mol甲分子反应生成1 mol 丙和3 mol乙,下列对此判断不正确的是( )

A. 1个乙分子中含有2个A原子
B. 甲的摩尔质量为17 g·mol-1
C. 同温同压下,生成丙和乙的体积比为1∶3
D. 标准状况下,11.2 L甲溶于500 mL水中,所得溶液中甲的物质的量浓度为1 mol·L-1
-
海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:


 ―→
―→ ―→
―→
粗盐中含Ca2+、Mg2+、Fe3+、SO 等杂质,提纯的步骤有:
等杂质,提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加入适量盐酸 ⑤溶解 ⑥过滤 ⑦蒸发,其正确的操作顺序是( )
A. ⑤②③①⑥④⑦ B. ⑤①②③⑥④⑦
C. ⑤②①③④⑥⑦ D. ⑤③①②⑥④⑦
-
在实验室从自来水制取蒸馏水的实验中,下列说法错误的是
A.烧瓶中要放入碎瓷片防止暴沸
B.温度计的水银球放在支管口附近位置,不能插入液面下
C.冷凝水应该是下进上出,与蒸气的流向相反
D.开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯
-
偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是( )
A. 偏二甲肼(C2H8N2)的摩尔质量为60g
B. 6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C. 1mol偏二甲肼(C2H8N2)的质量为60g/mol
D. 6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.NA个氧气分子与NA个氖气分子的质量比是4∶5
B.17gOH-与19gH3O+所含质子数相等
C.标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等
D.12g C和16g O所含的原子数不相等
-
下列说法正确的是( )
A. 在标准状况下,11.2 L某气体的质量为22 g,则该气体的相对分子质量是44 g/mol
B. 16 g O2和16 g O3含的氧原子个数一样多
C. 在标准状况下,水、氧气和氮气分子间的平均距离都相等
D. 1 mol氯化钙溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L