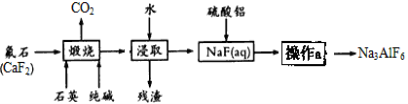
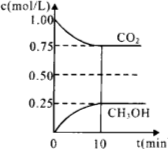
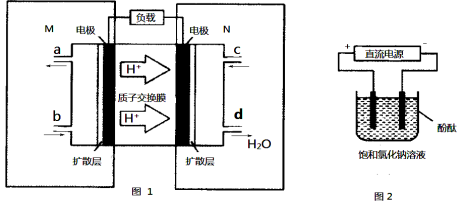
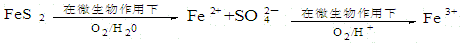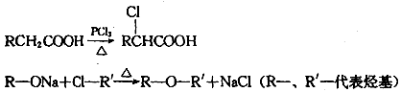-
生活中的一些问题常涉及到化学知识,则下列叙述不正确的是
A.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
B.明矾和漂白粉常用于自来水的净化,但两者的作用原理不相同
C.氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,能氧化单质铜
D.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则分别指的是对应的钙离子和铁离子
难度: 简单查看答案及解析
-
分子式为C5H10O2的有机物A,有果香味,在酸性条件下水解生成有机物B和C,其中C能被催化氧化成醛,则A可能的结构共有
A.1种 B.6种 C.9种 D.18种
难度: 困难查看答案及解析
-
下列有关的离子方程式书写正确的是
A.向铜片中滴加浓硫酸并加热,有刺激性气味气体产生:Cu + 4H+ + SO42-
Cu2+ + SO2↑ + 2H2O
B.服用阿司匹林过量出现水杨酸(
 )中毒反应,可静脉注射NaHCO3溶液:
)中毒反应,可静脉注射NaHCO3溶液: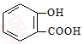 +2 HCO3- →
+2 HCO3- → 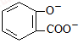 + 2 CO2↑ + 2 H2O
+ 2 CO2↑ + 2 H2OC.20mL 1.0mol/L的明矾溶液与10mL 3.5mol/LBa(OH)2溶液混合充分反应: 3Ba2+ + 6OH- +2Al3+ +3SO42- == 3BaSO4↓+2Al(OH)3↓
D.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3- +2OH-== CaCO3↓+2H2O+CO32-
难度: 极难查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。金属W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y的单质是常见的金属,可做海洋电池的负极材料。Z原子的质子数是同主族上一周期原子质子数的2倍。下列说法正确的是
A.由金属W制备的高效电池可用NH4Cl溶液作电解质
B.元素X与氢形成的化合物中不可能既有极性健又有非极性健
C.元素Y、Z分别形成的简单离子,后者的离子半径较前者大
D.元素Y、Z的最高价氧化物对应的水化物之间不能反应
难度: 困难查看答案及解析
-
Cyrneine A对治疗神经系统疾病有着很好的疗效,其可以用香芹酮经过多步反应合成:
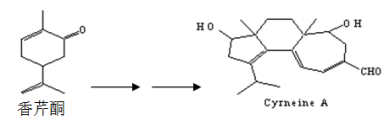
则下列有关的说法正确的是
A.香芹酮化学式为C9H12O,其一氯代物有12种
B.香芹酮分子中有8种不同化学环境的氢
C.Cyrneine A可以发生加成反应、氧化反应、酯化反应等,但不能发生消去反应
D.香芹酮和Cyrneine A均能够使溴水和酸性KMnO4溶液褪色
难度: 困难查看答案及解析
-
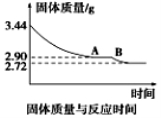
在不同温度下,水溶液中c(H+)与c(OH-)有如下图所示关系。下列关于离子共存说法中正确的是
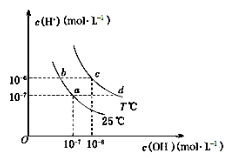
A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42—
B.b点对应的溶液中大量存在:NH4+、Ba2+、OH-、I-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO3—
D.d点对应的溶液中大量存在:Na+、K+、SO32—、Cl-
难度: 困难查看答案及解析
-
常温下,下列关系正确的是
A.新制氯水中加入固体NaOH:c(Na+) = c(Cl−) + c(ClO−) + c(OH−)
B.pH = 8.3的NaHCO3溶液:c(Na+)>c(HCO3−)>c(CO32−)>c(H2CO3)
C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH−) = c(CH3COO−) – c(CH3COOH)
D.向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4)
难度: 困难查看答案及解析