-
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A. “时气错逆,霾雾蔽日”,雾所形成的气溶胶能产生丁达尔效应
B. “青蒿一揭,以水二升溃,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化
C. “熬胆矾铁釜,久之亦化为铜”,北宋沈括用胆矾炼铜的过程属于置换反应
D. “外观如雪,强烧之,紫青烟起”,南北朝陶弘景对硝酸钾的鉴定过程中利用了焰色反应
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 标准状况下,22.4LCCl4中所含C—C1键的数目为4NA
B. 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
C. 向密闭容器中充入1molN2O4,加热使之充分分解,生成NO2的分子数为2NA
D. 7.8gNa2O2中阴离子所含的电子数为1.8NA
难度: 中等查看答案及解析
-
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )

A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物既能发生水解反应,又能发生氧化反应
D. 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种
难度: 困难查看答案及解析
-
下列依据实验操作及现象得出的结论正确的是( )
选项
实验操作
现象
结论
A
向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液
产生白色沉淀
试样已氧化变质
B
向Co2O3中滴入浓盐酸
产生黄绿色气体
氧化性:Co2O3>C12
C
向待测液中依次滴入氯水和KSCN 溶液
溶液变为红色
待测液中含有Fe2+
D
向Na2SO4和Na2CO3混合溶液中滴入AgNO3溶液
产生白色浑浊
Ksp(Ag2SO4)< Ksp(Ag2CO3)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列相关离子方程式书写正确的是( )
A. NH4HSO3溶液与少量的氢氧化钠溶液混合加热:NH4++OH-=NH3↑+H2O
B. 向NaHCO3溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+ CO32-
C. 等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D. “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2↑+3H2O
难度: 困难查看答案及解析
-
滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。用0.10mol·L-1NaOH溶液滴定0.10mol·L-1H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是( )
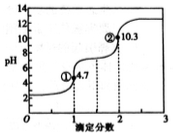
A. H2C2O4属于二元弱酸
B. 若用NaOH标准溶液滴定NaHC2O4溶液,可用酚酞作指示剂
C. 图中①处: c(Na+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
D. 图中②处:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
难度: 中等查看答案及解析

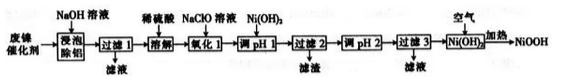

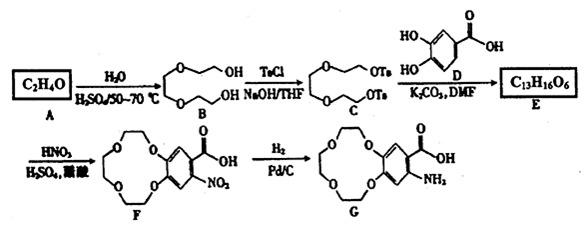
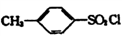 。
。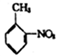 )和乙醇为原料(无机试剂任选),设计制备邻氨基苯甲酸乙酯(
)和乙醇为原料(无机试剂任选),设计制备邻氨基苯甲酸乙酯(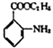 )的合成路线。_________________
)的合成路线。_________________