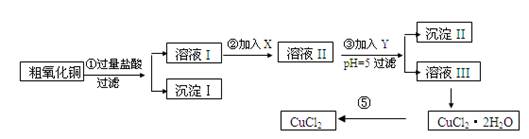
-
25℃时,在浓度为1 mol·L-1的(NH4)2SO4、(NH4)2 CO3、(NH4)2Fe(SO4)2的溶液中,测得c(NH4+)分别为a、b、c(单位为mol·L-1)。下列判断正确的是 ( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
难度: 简单查看答案及解析
-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X) =v(Y) D.3v(W)=2v(X)
难度: 简单查看答案及解析
-
用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是( )
A.Na2SO4 B.NaOH C.HCl D.NaCl
难度: 简单查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.c(H+) B.pH C.NH3·H2O 的电离度 D.OH-的物质的量
难度: 简单查看答案及解析
-
在恒温恒压的条件下,一密闭容器内发生反应:2NO2(g)
N2O4(g),达平衡时,再向容器内通入一定量的NO2(g),重达平衡后,与第一次平衡时相比,NO2的体积分数( )
A、不变 B、增大 C、减小 D、无法判断
难度: 简单查看答案及解析
-
对于溶液的酸碱性说法正确的是 ( )
A.c(H+)很小的溶液一定呈碱性 B.pH等于7的溶液一定呈中性
C.c(H+)=c(OH-)的溶液一定呈中性 D.不能使酚酞试液变红的溶液一定呈酸性
难度: 简单查看答案及解析
-
现有X(g)+Y(g)
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的( )
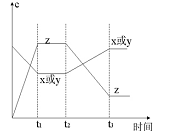
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
难度: 简单查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
C.用广泛pH试纸测得某溶液的pH为2.3
D.用托盘天平称量25.20g NaCl
难度: 简单查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NaCl固体 ④CH3COONa固体 ⑤KCl溶液
A.①② B.②③⑤ C.②④ D.②④⑤
难度: 简单查看答案及解析
-
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
A. HCN是共价化合物
B. HCN易溶于水
C. 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D. c(H+)和溶液体积均相同的氢氰酸与盐酸相比,前者中和能力强
难度: 简单查看答案及解析
-
在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离度增大,H+ 浓度减小,可采用的方法是 ( )
A.加热 B.加入1mol/L 的醋酸溶液100mL
C.加入少量的0.5mol/L的硫酸 D.加入少量的1mol/L 的NaOH溶液
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.
的溶液中:
、
、
、
B.由水电离的
的溶液中:
、
、
、
C.
的溶液中:
、
、
、
D.
的溶液中:
、
、
、
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.铅蓄电池在放电过程中,负极、正极质量都增加
B.常温下,反应
不能自发进行,则该反应的
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中
、
、
的氧化性依次减弱
难度: 简单查看答案及解析
-
下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是
难度: 简单查看答案及解析
-
下列解释实验事实的方程式不正确的是 ( )
A.0.1
/L
溶液的pH>1:
CHCOO-+H+
B.“
球”浸泡在冷水中,颜色变浅
2
(g) (红棕色)
N2O4 (g) (无色),△H<0
C.铁溶于稀硝酸,溶液变黄:
3Fe+8H++2N
3Fe2++2NO↑+4H2O
D.向Na2CO3溶液中滴入酚酞溶液,溶液变红:
CO32— + H2O
H CO3— + OH—
难度: 简单查看答案及解析
-
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7 B.2.0 C.12.0 D.12.4
难度: 简单查看答案及解析
-
向AgCl饱和溶液中加水,下列叙述正确的是 ( )
A.AgCl的溶解度增大 B.AgCl的溶解度、Ksp均不变
C.AgCl的Ksp增大 D.AgCl的溶解度、Ksp均增大
难度: 简单查看答案及解析
-
在100ml 0.01mol/LKCl溶液中,加入1ml0.01mol/LAgNO3溶液,下列说法正确的是(已知 AgCl的Ksp=1.8×10-10) ( )
A.有AgCl沉淀析出 B.无AgCl沉淀析出
C.有沉淀析出,但不是AgCl D.无法确定是否有沉淀析出
难度: 简单查看答案及解析
-
下列溶液中微粒浓度关系一定正确的是( )
A.室温时,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.室温时,pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
难度: 简单查看答案及解析
-
在一定温度下的定容密闭容器中,当下列物理量不再改变时,不能表明反应
A(s)+2B(g)
C(g)+D(g)已达平衡的是 ( )
A.混合气体的压强 B.混合气体的密度
C.混合气体的相对分子质量 D.C的物质的量
难度: 简单查看答案及解析
-
关于热化学方程式:2H2(g)+O2(g)=2H2O(1),△H=-571.6 kJ·mol-1,下列有关叙述不正确的 ( )
A.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热
B.1mol H2完全燃烧生成液态水时放出285.8kJ的热
C. 2mol H2完全燃烧生成液态水时放出571.6 kJ的热
D.上述热化学方程式也可表示为H2(g)+ 1/2O2(g)=H2O(1), △H=-285.8 kJ·mol-1
难度: 简单查看答案及解析
-
pH均为6的盐酸和NH4Cl溶液,其中水电离出的c(H+)值分别是x mol·L-1、y mol·L-1,两者的关系是 ( )
A.相等 B.x>y C.x=10-2y D.x=102y
难度: 简单查看答案及解析