-
化学与生产和生活密切相关。下列说法不正确的是
A. 明矾用于净水。氯气用于消毒,都涉及化学变化
B. 糖类、油脂、蛋白质均可发生水解反应
C. 从煤和石油中加工制得的苯是一种重要的化工原料
D. 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 1molNa2O2与水完全反应、转移电子数为NA个
B. 将NA个NH3分子溶于1L水中所得氨水的浓度为1mol·L-1
C. 标准状况下22.4L氮气与22.4L苯所含分子数均为NA
D. 向含有0.2mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗OH-的数目为0.8NA
难度: 困难查看答案及解析
-
TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。TPE的结构简式如图,下列关于TPE的说法正确的是
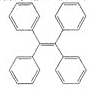
A. TPE属于苯的同系物
B. TPE能发生加成反应,但不能取代反应
C. TPE与化合物
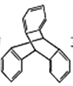 互为同分异构体
互为同分异构体D. TPE的一氯代物有3种
难度: 中等查看答案及解析
-
下列实验装置正确且能达到实验目的的是
A
B
C
D
实验目的
比较盐酸、碳酸、硅酸的酸性强弱
检验碳与浓H2SO4反应的产物中含CO2
验证铁的析氢腐蚀
模拟电解精炼铜
实验装置
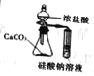
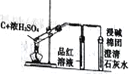
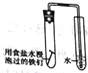
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,X的最外层电子数是电子层数的2倍,Y 和Z位于同一主族。甲、乙、丙为其中三种元素对应的单质,m、n、p均为由这些元素组成的二元化合物,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是
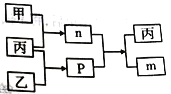
A. 原子半径:W<X<Y
B. W与X组成的化合物中只含有极性键
C. X、Y、Z三元素可形成XYZ型化合物
D. W 与X、Y、Z组成的简单化合物的稳定性X>Y >Z
难度: 困难查看答案及解析
-
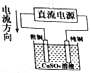
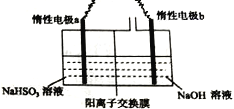
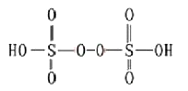
利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是

A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
难度: 困难查看答案及解析
-
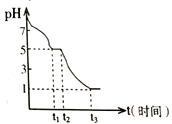
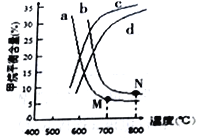
常温下,向浓度均为0.1 mol•L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH 固体,lg
随加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是.
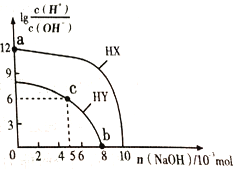
A. HX的酸性弱于HY
B. c点溶液中c(Y-)<c(HY)
C. a点由水电离出的c(H+)=10-12 mol•L-1
D. b点溶液中离子浓度大小关系为c(Y-)+c(HY)=c(Na+)+0.02 mol•L-1
难度: 困难查看答案及解析
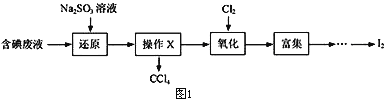

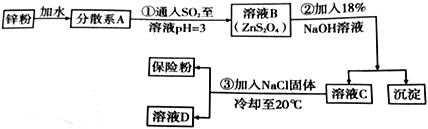


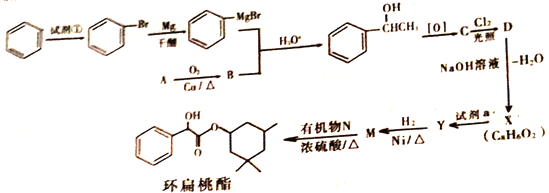
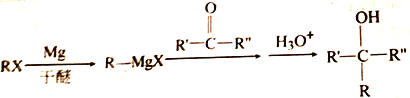 (R、R'、R〞代表烃基或氢)
(R、R'、R〞代表烃基或氢) F
F