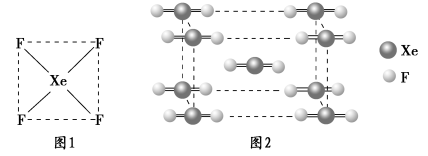
-
纳米材料是21世纪最有前途的新型材料之一,世界各国对这一新材料给予了极大的关注。纳米粒子是指直径为1~100 nm的超细粒子(1 nm=10-9 m)。由于表面效应和体积效应,其常有奇特的光、电、磁、热等性能,可开发为新型功能材料,有关纳米粒子的叙述不正确的是( )。
A.因纳米粒子半径太小,故不能将其制成胶体
B.一定条件下纳米粒子可催化水的分解
C.一定条件下,纳米陶瓷可发生任意弯曲,可塑性好
D.纳米粒子半径小,表面活性高
难度: 中等查看答案及解析
-
最近科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )。
A.该物质的化学式为CO4
B.晶体的熔、沸点高,硬度大
C.晶体中C原子数与C—O键数之比为1∶4
D.晶体的空间最小环共由12个原子所构成
难度: 中等查看答案及解析
-
下列各类物质中,固态时只能形成离子晶体的是( )。
A.非金属氧化物 B.非金属单质 C.强酸 D.强碱
难度: 中等查看答案及解析
-
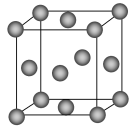
干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为
a(其中a为立方体棱长)的CO2有( )。
A.4个 B.8个 C.12个 D.6个
难度: 中等查看答案及解析
-
下列对化学知识概括合理的是( )。
A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B.同素异形体之间的转化都是物理变化
C.原子晶体的熔点不一定比金属晶体的高,分子晶体的熔点不一定比金属晶体的低
D.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
难度: 中等查看答案及解析
-
已知A元素原子核外电子共占有5个轨道且有2个成单电子;B元素原子核外能量最高电子为:n=3、l=1、m=1、ms=+
,n=3、l=1、m=0、ms=+
。则A、B两元素所形成化合物的晶体类型为( )。
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
难度: 中等查看答案及解析
-
氢是重要而洁净的能源。要利用氢气作为能源,必须解决好安全有效地储存氢气的问题。化学家研究出利用合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为( )。
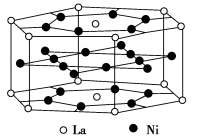
A.LaNi5 B.LaNi C.La14Ni24 D.La7Ni12
难度: 中等查看答案及解析
-
某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶角和面心,则该晶体的化学式为( )。

A.B2A B.BA2 C.B7A4 D.B4A7
难度: 中等查看答案及解析